-
室温下,有两种溶液:①0.01 mol·L-1 NH3·H2O溶液 ②0.01 mol·L-1 NH4Cl溶液,下列操作可以使两种溶液中c(NH4+)都增大的是( )
A.加入少量H2O B.加入少量NaOH固体
C.通入少量HCl气体 D.升高温度
难度: 简单查看答案及解析
-
下列表示电离或水解方程式正确的是( )
A.H2S=2H++S2-
B.KHCO3=K++H++CO32-
C.HCO3-+H2O
H2CO3+OH-
D.HClO=H++ClO-
难度: 中等查看答案及解析
-
某兴趣小组设计了如图所示原电池装置(盐桥中吸附有饱和K2SO4溶液)。下列说法正确的是
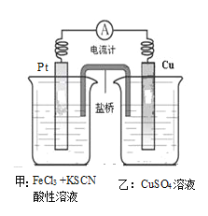
A.该原电池的正极反应是Cu2++2e-===Cu
B.甲烧杯中溶液的血红色逐渐变浅
C.盐桥中的SO42-流向甲烧杯
D.Cu电极质量减少,Pt电极质量增加
难度: 中等查看答案及解析
-
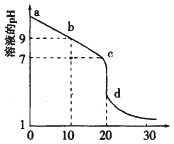
一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是( )
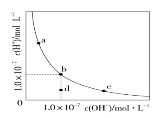
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
难度: 中等查看答案及解析
-
实验室用标准盐酸测定某NaOH溶液的浓度,用甲基橙作指示剂,下列对测定结果评价错误的是
选项
操作
测定结果评价
A
酸式滴定管在装液前未用标准盐酸润洗2~3次
偏高
B
开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
偏高
C
锥形瓶未干燥
无影响
D
盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
偏低
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
由硫酸钾、硫酸铝和硫酸组成的混合溶液,pH=1,c(Al3+)=0.4mol•L-1,c(SO42-)=0.8mol•L-1,则c(K+)=( )
A.0.15mol•L-1 B.0.2mol•L-1
C.0.3mol•L-1 D.0.4mol•L-1
难度: 中等查看答案及解析
-
如下图所示,下列关于实验现象的描述正确的是( )
a电极
b电极
x溶液
实验现象
A
石墨
石墨
CuCl2
a电极质量增加,b电极放出无色气体
B
Fe
石墨
KNO3
a电极质量增加,b电极放出无色气体
C
Fe
Cu
CuSO4
a电极质量增加,b电极质量减少
D
石墨
石墨
HCl
A电极放出无色气体,b电极放出无色气体
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列有关电解质溶液的说法正确的是( )
A.向0.1mol/L的CH3COOH溶液中加少量水,溶液中
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中
增大
C.向盐酸中加入氨水至中性,溶液中
>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中
>1
难度: 困难查看答案及解析
-
下列说法正确的是( )
A.常温下,向pH为2的盐酸中加入等体积的pH=12的氨水恰好完全中和
B.Na2CO3溶液中c(Na+)与c(CO32-)之比为2:1
C.0.2 mol•L-1与0.1 mol•L-1醋酸中c(H+)之比为2:1
D.pH=1的溶液中NH4+、Cl-、Cu2+、SO42-一定能大量共存
难度: 中等查看答案及解析
-
常温下,Ksp(CaSO4)=9×10-4,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。下列判断中正确的是( )
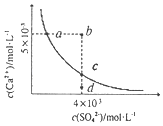
A.a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液
B.向d点溶液中加入适量CaCl2固体可以变到c点
C.a点对应的Ksp不等于c点对应的Ksp
D.b点将有沉淀生成,平衡后溶液中c(SO42-)=3×10-3mol/L
难度: 中等查看答案及解析
-
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。该电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“-”。高铁电池的总反应为:3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是( )
A.放电时正极反应为:FeO42-+3e-+4H2O=Fe(OH)3↓+5OH-
B.充电时阴极反应为:Zn(OH)2+2e-=Zn+2OH-
C.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化
D.标有“+”的接线柱充电时作阳极,放电时作正极
难度: 中等查看答案及解析
-
X、Y、Z、M代表四种金属元素,金属X和Z用导线连接放入稀硫酸中时,Z极上有H2放出;若电解Y2+和Z2+共存的溶液时,Y先析出;又知M2+的氧化性强于Y2+。则这四种金属的活动性由强到弱的顺序为( )
A.X>Z>Y>M B.X>Y>Z>M
C.M>Z>X>Y D.X>Z>M>Y
难度: 中等查看答案及解析
-
2008年10月8日,瑞典皇家科学院宣布美籍华裔科学家钱永健获得2008年度诺贝尔化学奖。少年时代,他就对化学产生了浓厚的兴趣。16岁时,他凭借一个金属易受硫氰酸盐腐蚀的调查项目,荣获具有“少年诺贝尔奖”之称的著名奖项。下列说法正确的是( )
A.金属腐蚀就是金属失去电子被还原的过程
B.将水库中的水闸(钢板)与外加直接电源的负极相连,正极连接到一块废铁上可防止水闸被腐蚀
C.由原电池原理知所有的合金都比纯金属更易被腐蚀
D.铜板上的铁铆钉处在潮湿的空气中发生:Fe-3e-═Fe3+,从而形成铁锈,但此过程铜不被腐蚀
难度: 中等查看答案及解析
-
下列叙述中不正确的是( )
A.锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后,再将不溶物用稀盐酸溶解去除
B.向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体的原理是加热促进了Fe3+水解
C.向纯水中加入盐酸或降温都能使水的离子积减小,电离平衡逆向移动
D.反应2A(g)+B(g)=3C(s)+D(g)在一定条件下能自发进行,说明该反应的△H<0
难度: 中等查看答案及解析
-
常温下,将pH均为3,体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随1g
的变化如右图所示。下列说法正确的是
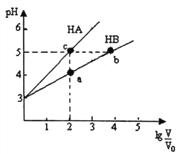
A.稀释相同倍数时:c(Aˉ)>c(Bˉ-)
B.水的电离程度:b=c>a
C.溶液中离子总物质的量:b>c>a
D.溶液中离子总浓度:a>b>c
难度: 困难查看答案及解析
-
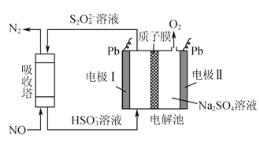
微生物燃料电池在净化废水的同时能获得能源或得到有价值的化学产品,图1为其工作原理,图2为废水中Cr2O72-离子浓度与去除率的关系。下列说法不正确的是
图1
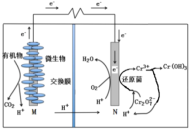 图2
图2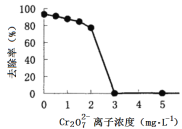
A. M为电源负极,有机物被氧化
B. 电池工作时,N极附近溶液pH增大
C. 处理1molCr2O72-时有6 molH+从交换膜左侧向右侧迁移
D. Cr2O72-离子浓度较大时,可能会造成还原菌失活
难度: 困难查看答案及解析
-
下列化学原理的应用,主要用沉淀溶解平衡原理来解释的是( )
①热纯碱溶液的洗涤油污能力强;
②误将钡盐[BaCl2、Ba(NO3)2]当作食盐食用时,常用0.5%的Na2SO4溶液解毒;
③溶洞、珊瑚的形成;
④碳酸钡不能做“钡餐”而硫酸钡则能;
⑤泡沫灭火器灭火的原理。
A.②③④ B.①②③ C.③④⑤ D.①②③④⑤
难度: 中等查看答案及解析
-
用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如下图所示(a、b为石墨电极).下列说法中,正确的是
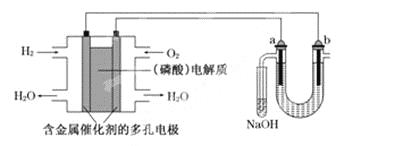
A. 电池工作时,正极反应式为: O2+2H2O+4e-===4OH-
B. 电解时,a电极周围首先放电的是Br-而不是Cl-,说明当其他条件相同时前者的还原性强于后者
C. 电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D. 忽略能量损耗,当电池中消耗0.02 g H2时,b极周围会产生0.04 g H2
难度: 困难查看答案及解析
-
现有两正盐的稀溶液,分别是amol/LNaX溶液和bmol/LNaY溶液。下列说法不正确的是
A.若a>b,测得c(X-)=c(Y-),可推出溶液中的c(HX)>c(HY)
B.若a>b,测得c(X-)=c(Y-),可推出酸性HX>HY
C.a=b,且pH(NaX)>pH(NaY),则相同浓度时,酸性HX<HY
D.a=b,并测得a= c(X-)=c(Y-)+c(HY),则HX是强酸,HY是弱酸
难度: 困难查看答案及解析
-
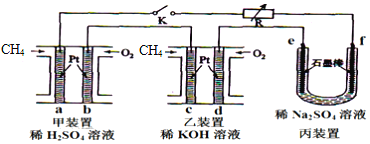
按如图所示装置进行下列不同的操作,
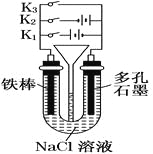
其中不正确的是
A.铁腐蚀的速度由大到小的顺序是:只接通K1>只闭合K3>都断开>只闭合K2
B.只接通K1,一段时间后,U形管中出现白色沉淀
C.只接通K2,U形管左、右两端液面均下降
D.先只接通K1,一段时间后,漏斗液面上升,然后再只接通K2,漏斗液面下降
难度: 困难查看答案及解析