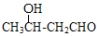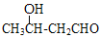-
在稳定人体血液的pH中起作用的离子是
A.Na+ B.HCO3- C.Fe2+ D.Cl-
难度: 简单查看答案及解析
-
已知
的相对原子质量为34.969,下列相关说法正确的是( )
A.氯元素的近似相对原子质量为35
B.氯元素的某种同位素的质量数为35
C.氯元素的中子数为18
D.氯原子的质量为34.969
难度: 中等查看答案及解析
-
溶液受热不能分解的物质是( )
A.HClO B.HNO3 C.Ca(HCO3)2 D.NaNO3
难度: 简单查看答案及解析
-
下列对有机物的性质描述正确的是( )
A.含有羟基的有机物都能与醋酸发生酯化反应
B.氨基酸、乙酸和苯酚都能与氢氧化钠溶液反应
C.醇类、卤代烃都能发生消去反应
D.除饱和烃之外的其他烃都能发生聚合反应
难度: 中等查看答案及解析
-
2015年8月12日天津港国际物流中心内某公司的危险品仓库发生严重火灾,涉及的危险品包括压缩液化气体、电石和过氧化物等。以下灭火方法正确的是( )
A.使用大量水 B.使用泡沫式灭火器
C.使用黄沙 D.使用干粉(NaHCO3)
难度: 简单查看答案及解析
-
下列物质的有关性质,能用共价键键能大小解释的是
A.还原性:HI>HF B.溶解度:HF>HI
C.沸点:HF>HI D.热分解温度:HF>HI
难度: 简单查看答案及解析
-
勒夏特列原理是自然界一条重要的基本原理,下列事实能用勒夏特列原理解释的是
A.NO2气体受压缩后,颜色先变深后变浅
B.对2HI(g)
H2(g)+I2(g)平衡体系加压,颜色迅速变深
C.合成氨工业采用高温、高压工艺提高氨的产率
D.配制硫酸亚铁溶液时,常加入少量铁屑以防止氧化
难度: 中等查看答案及解析
-
下列各组物质均属于分子晶体且均为化合物的是( )
A.NH3、HD、C10H8 B.PCl3、CO2、AlCl3
C.SO2、SiO2、P2O5 D.CCl4、H2O2、Na2S
难度: 简单查看答案及解析
-
其它条件不变时仅升高温度,一定增大的是( )
A.强碱在水中的溶解度 B.吸热反应的热效应
C.化学平衡常数K D.盐类水解程度
难度: 简单查看答案及解析
-
对如图装置(铁的防护)的分析正确的是( )
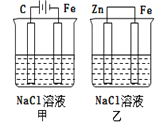
A.甲装置是牺牲阳极的阴极保护法
B.乙装置是牺牲阳极的阴极保护法
C.一段时间后甲、乙装置中pH均增大
D.甲、乙装置中铁电极的电极反应式均为:2H++2e→H2↑
难度: 中等查看答案及解析
-
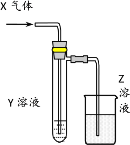
《Inorganic Syntheses》(无机合成)一书中,有一如右图所示的装置,用以制备某种干燥的纯净气体。

该装置中所装的药品正确的是
A.A中装浓硫酸,B中装浓盐酸
B.A中装浓盐酸,B中装浓硫酸
C.A中装氢氧化钠浓溶液,B中装浓氨水
D.A中装浓氨水,B中装氢氧化钠浓溶液
难度: 中等查看答案及解析
-
用以下图示装置研究物质的性质,能够获得可靠结论的是
X
Y
Z
结论
A
HCHO
新制Cu(OH)2
NaOH(aq)
验证甲醛的还原性
B
CH3Cl
AgNO3(aq)
NaOH(aq)
验证一氯甲烷含氯元素
C
SO2
KMnO4(aq)
NaOH(aq)
验证二氧化硫的漂白性
D
Cl2
淀粉KI(aq)
NaOH(aq)
验证氯气的强氧化性
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
高铁酸钠(Na2FeO4)可用于城市自来水处理。下列相关分析正确的是( )
A. Na2FeO4溶液显强碱性,能消毒杀菌
B. Na2FeO4具有强氧化性,能消毒杀菌
C. Na2FeO4的氧化产物Fe3+易水解为Fe(OH)3,可以净水
D. Na2FeO4的还原产物Fe2+易水解为Fe(OH)2,可以净水
难度: 简单查看答案及解析
-
咖啡酸的结构如图所示。关于咖啡酸的描述不正确的是( )
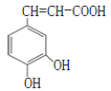
A.分子式为C9H8O4
B.1mol咖啡酸最多能与4mol氢气发生加成反应
C.遇溴水,既能发生取代反应又能发生加成反应
D.能还原酸性KMnO4溶液,说明其分子中含有碳碳双键
难度: 中等查看答案及解析
-
强电解质甲、乙、丙、丁分别溶于水,电离出NH4+、Ba2+、Mg2+、H+、OH-、Cl-、HCO3-、SO42-(每种溶液中溶质电离出的离子各不相同)。已知:① 甲溶液分别与其它三种溶液混合,均产生白色沉淀;② 0.1 mol·L-1乙溶液中c(H+)>0.1 mol·L-1;③ 向丙溶液中滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀。下列结论不正确的是( )
A.四种物质中一定有共价化合物 B.四种物质中一定有Ba(OH)2
C.丙溶液加热蒸干可得原无水溶质 D.丁溶液中含有HCO3-
难度: 中等查看答案及解析
-
短周期元素甲、乙、丙、丁的原子序数依次增大,甲原子核外有三种能量不同的电子。乙、丙和丁的原子核外均有一个未成对电子。甲、乙、丙最高价氧化物对应的水化物两两之间能相互反应。下列说法错误的是( )
A.元素丙的单质可用于冶炼金属 B.丙与丁形成的化合物能升华
C.甲与乙形成的化合物溶于水呈酸性 D.简单离子半径:丁>乙>丙
难度: 中等查看答案及解析
-
某只含铁、氧两种元素的样品A,高温时与足量的CO充分反应,生成的气体被足量澄清石灰水吸收,测得沉淀的质量与原样品A质量相等。如果A中只含两种物质,则A中一定含有( )
A. FeO B. Fe2O3 C. Fe3O4 D. Fe
难度: 中等查看答案及解析
-
离子方程式:Ca2++HCO3-+OH- → CaCO3↓+H2O不能表示的反应有( )
A.澄清石灰水与碳酸氢钠溶液 B.澄清石灰水与碳酸氢铵溶液
C.氢氧化钠溶液与碳酸氢钙溶液 D.澄清石灰水与碳酸氢钙溶液
难度: 简单查看答案及解析






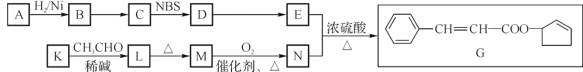
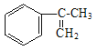 经过四步不同类型的反应制得阿托酸。请按实际进行的反应顺序写出指定反应步骤中所需要的试剂和反应条件:
经过四步不同类型的反应制得阿托酸。请按实际进行的反应顺序写出指定反应步骤中所需要的试剂和反应条件: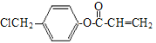 是阿托酸甲酯的某种同分异构体的一氯代物,其与足量氢氧化钠溶液共热,生成的有机产物的结构简式为_____________________________________。
是阿托酸甲酯的某种同分异构体的一氯代物,其与足量氢氧化钠溶液共热,生成的有机产物的结构简式为_____________________________________。