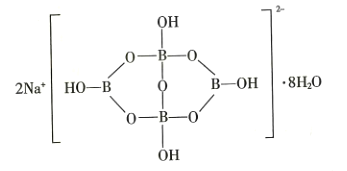
-
下列有关物质(括号内为杂质)的提纯方法正确的是
A.丙烷(丙烯)——通入酸性高锰酸钾溶液
B.苯(苯酚)——加入氢氧化钠,分液
C.丙酸乙酯(丙酸)——加入稀硫酸
D.甘油(水)——分液
难度: 中等查看答案及解析
-
化学与生活密切相关,下列应用中一定发生了氧化还原反应的是
A.食醋除去水壶的水垢 B.氯气作自来水的消毒剂
C.二氧化硫漂白草帽 D.石膏点豆腐
难度: 简单查看答案及解析
-
若能层序数n=3,则下列能级符号错误的是
A.ns B.np C.nd D.nf
难度: 简单查看答案及解析
-
下列实验操作或事故的处理方法正确的是
A.鼻子凑近化学药品闻气味 B.金属钠着火可用水扑灭
C.处理
尾气时将导管直接插入水中 D.蒸馏实验在烧瓶中加碎瓷片防暴沸
难度: 简单查看答案及解析
-
下列物质互为同分异构体的是
A.
和
B.
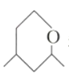 和
和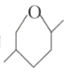
C.
和
D.
和
难度: 简单查看答案及解析
-
已知:①
kJ·mol-1
②
kJ·mol-1
③
kJ·mol-1
下列说法正确的是
A.
的燃烧热
kJ·mol-1
B.
kJ·mol-1
C.等物质的量的
和
完全燃烧,
放出的热量更多
D.在中性溶液中,
和
不能形成燃料电池
难度: 中等查看答案及解析
-
下列生活用品的主要成分不属于高分子化合物的是
A.汽油 B.塑料袋 C.纸张 D.羊毛衫
难度: 简单查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是
A.铁粉具有还原性,可用作抗氧化剂 B.
硬度大,可用作半导体材料
C.浓硫酸具有脱水性,可用作干燥剂 D.
易溶于水,可治疗胃酸过多
难度: 简单查看答案及解析
-
化合物
(如图)是一种重要的材料中间体,下列有关化合物
的说法中正确的是
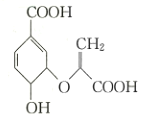
A.分子中含有三种官能团
B.可与乙醇、乙酸反应
C.所有碳原子一定处于同一平面
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
难度: 中等查看答案及解析
-
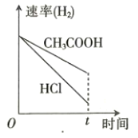
向体积和pH均相等的盐酸和醋酸中分别加入足量的镁粉,则下列关于反应产生
的体积(同温同压下测定)和速率与时间的关系图像描述正确的是
A.
 B.
B.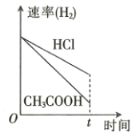
C.
 D.
D. 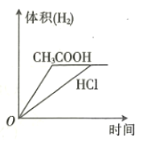
难度: 简单查看答案及解析
-
中科院科学家们研究开发了一种柔性手机电池,示意图如图所示[其中多硫化锂(Li2Sx)中x=2、4、6、8]。下列说法错误的是
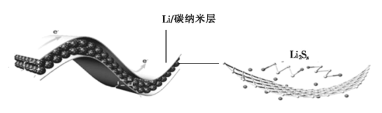
A.碳纳米层具有导电性,可用作电极材料
B.放电时,Li+移向Li2Sx膜
C.电池工作时,正极可能发生反应:2Li2S6+2Li++2e-=3Li2S4
D.电池充电时间越长,电池中Li2S2的量越多
难度: 困难查看答案及解析
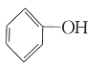 浊液中加入足量的
浊液中加入足量的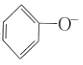
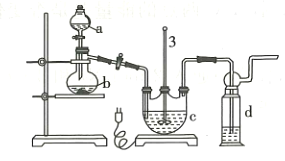
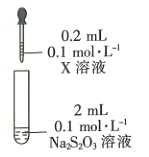
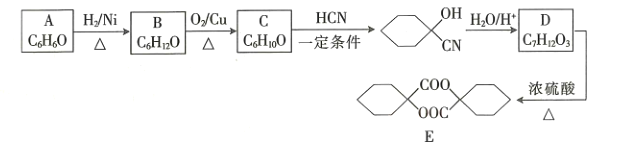
 的反应类型是_________________,D中官能团的名称是________________。
的反应类型是_________________,D中官能团的名称是________________。 的合成路线______________(无机试剂任选)。
的合成路线______________(无机试剂任选)。