-
东晋葛供《肘后备急方》中“青蒿一握,以水升渍,绞取汁,尽服之”。下列操作与“渍”和“绞”原理相近的是
A. 煮沸 研碎 B. 浸泡 过滤 C. 萃取 剪断 D. 蒸馏 捣碎
难度: 简单查看答案及解析
-
下列说法正确的是 (NA为阿伏加德罗常数的值) ( )
A. 28 g氮气含有的原子数为NA
B. 4 g金属钙变成钙离子时失去的电子数为0.1 NA
C. 1 mol O2分子的质量等于1 mol氧原子的质量
D. 24 g O2 和24 g O3所含的氧原子数目相等
难度: 简单查看答案及解析
-
下列物质的用途不正确的是( )
A.硅是制造光导纤维的材料
B.硅是制造太阳能电池的常用材料
C.二氧化硅是制取粗硅的原料
D.水玻璃可用作木材防火剂
难度: 中等查看答案及解析
-
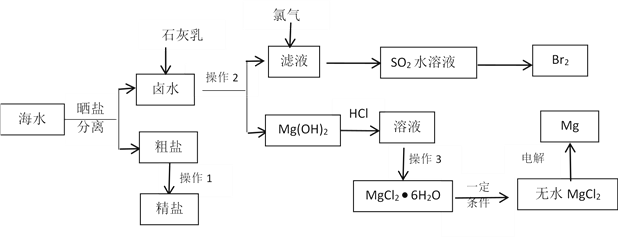
根据表1信息,判断以下叙述正确的是( )
表1 部分短周期元素的原子半径及主要化合价
元素代号
L
M
Q
R
T
原子半径/nm
0.160
0.143
0.112
0.104
0.066
主要化合价
+2
+3
+2
+6、-2
-2
A.氢化物的沸点为H2T<H2R B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性 D.L2+与R2-的核外电子数相等
难度: 中等查看答案及解析
-
常温下,某溶液中由水自身电离产生的H+、OH-,其浓度满足c(H+)•c(OH-)=10-24,该溶液中一定能够大量存在的离子组是( )
A.Ba2+、Na+、Cl-、NO3- B.Al3+、Ca2+、SO42-、Br-
C.NH4+、K+、HSO3-、CO32- D.Na+、K+、MnO4-、I-
难度: 中等查看答案及解析
-
用图表示的一些物质或概念间的从属关系中正确的是
X
Y
Z
A
液氯
非电解质
纯净物
B
电解质
盐
化合物
C
胶体
分散系
混合物
D
酸性氧化物
非金属氧化物
氧化物
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是( )
A.铝粉投入到NaOH溶液中:2Al+2OH-══ 2AlO2-+H2↑
B.AlCl3溶液中加入足量的氨水:Al3++ 3OH- ══ Al(OH)3↓
C.三氯化铁溶液中加入铁粉:
D.FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl-
难度: 中等查看答案及解析
-
检验氯化氢气体中是否混有氯气,不可采用的方法是
A.用紫色的石蕊溶液 B.用湿润的有色布条
C.将气体通入硝酸银溶液. D.用湿润的淀粉碘化钾试纸
难度: 简单查看答案及解析
-
下列化学应用中不涉及氧化还原反应的是
A.Na2S水溶液在空气中变浑浊
B.生活中使用明矾净水,除去水中的悬浮颗粒
C.溶有二氧化氮的浓硝酸做火箭的助燃剂
D.漂白粉漂白有色布条
难度: 中等查看答案及解析
-
下列实验过程中,始终无明显现象的是
A.NO2通入FeSO4溶液中 B.SO2通入已酸化的Ba(NO3)2溶液中
C.CO2通入Na2SiO3溶液中 D.SO2通入CaCl2溶液中
难度: 中等查看答案及解析
-
苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式为
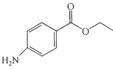 。下列关于苯佐卡因的叙述正确的是
。下列关于苯佐卡因的叙述正确的是A. 分子式为C9H14NO2
B. 苯环上有2个取代基,且含有硝基的苯佐卡因的同分异构体有9种
C. 1mol该化合物最多与4mol氢气发生加成反应
D. 分子中将氨基转化成硝基的反应为氧化反应
难度: 中等查看答案及解析
-
下列关于甲、乙、丙、丁四种有机物的说法正确的是
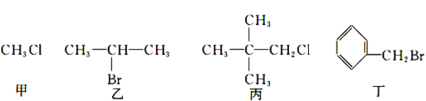
A.分别加入AgNO3溶液,均有沉淀生成
B.加入NaOH溶液共热,然后加入稀硝酸调至酸性,再滴入AgNO3溶液,均有沉淀生成
C.加入NaOH的醇溶液共热,后加入稀硝酸至酸性,再滴入AgNO3溶液,均有沉淀生成
D.乙发生消去反应得到两种烯烃
难度: 简单查看答案及解析
-
下列有关概念或原理的叙述正确的是 ( )
A.氨基酸、蛋白质和氧化铝一样既能与酸反应,又能与碱反应,所以它们都是两性氧化物
B.制造婴儿用的一次性纸尿片采用的吸水保水的材料可以是
C.乙烯和聚乙烯都能使酸性
溶液褪色
D.甲酸乙酯、葡萄糖、麦芽糖、淀粉这四种物质的共同性质是,它们既可以发生水解反应,又可以发生银镜反应
难度: 中等查看答案及解析
-
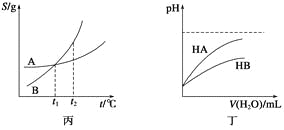
关于下列各图的叙述,正确的是( )
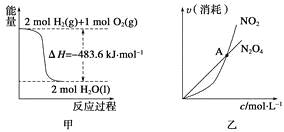
A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6 kJ·mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2(g)
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液的pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液
难度: 中等查看答案及解析
-
下列热化学方程式中,正确的是( )
A. 甲烷的燃烧热为 890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ/mol
B. 500℃、30MPa 下,将 0.5mol N2和 1.5molH2置于密闭容器中充分反应生成 NH3(g),放热 19.3 kJ,其热化学方程式为:N2(g)+3H2(g)
 2NH3(g) △H = -38.6 kJ/mol
2NH3(g) △H = -38.6 kJ/molC. 稀盐酸和 稀氢氧化钠溶液混合, 其热化学方程式为:H+(aq)+OH-(aq)=H2O(1) △H = -57.3 kJ/mol
D. 1molH2完全燃烧放热 142.9kJ,则氢气燃烧的热化学方程式为: 2H2(g)+O2(g)=2H2O(1)△H =+285.8 kJ/mol
难度: 中等查看答案及解析
-
已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)= 2C3H5(ONO2)3(l) △H1;
H2(g)+
O2(g)=H2O(g) △H2 ; C(s)+O2(g)=CO2(g) △H3
则反应4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g)+O2(g)+6N2(g)的△H为( )
A.12△H3+10△H2﹣2△H1 B.2△H1﹣10△H2﹣12△H3
C.12△H3﹣10△H2﹣2△H1 D.△H1﹣10△H2﹣12△H3
难度: 中等查看答案及解析
-
对于反应A(g)+3B(g)
2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
A.v(A)=0.02 mol/(L·s) B.v(B)=0.03 mol/(L·s)
C.v(B)=0.90 mol/(L·min) D.v(C)=0.60 mol/(L·min)
难度: 简单查看答案及解析
-
向1L的密闭容器中加入1molX、0.3molZ和一定量的Y三种气体。一定条件下发生反应,各物质的浓度随时间变化如图一所示。图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。下列说法不正确的是
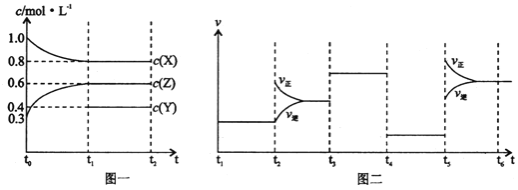
A.Y的起始物质的量为0.5mol
B.该反应的化学方程式为:2X(g)+Y(g)
3Z(g)∆H<0
C.若t0=0,t1=10s,则t0~t1阶段的平均反应速率为v(Z)=0.03mol/(L·s)
D.反应物X的转化率t6点比t3点高
难度: 中等查看答案及解析
-
下列装置或操作能达到实验目的的是
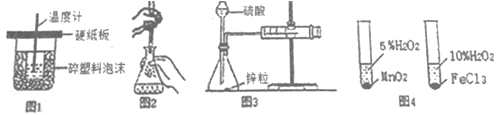
A.图1装置用于中和热的测定
B.图2装置用于高锰酸钾溶液滴定草酸
C.图3装置用于测定氢气的反应速率(单位mL/s)
D.图4装置用于研究不同催化剂对反应速率的影响
难度: 中等查看答案及解析
-
相同条件下,下列有关溶液的比较中,不正确的是( )
①pH=2的CH3COOH溶液 ②pH=2的HCl溶液 ③pH=12的氨水 ④pH=12的NaOH溶液
A. 水电离出的c(H+):①=②=③=④
B. 将②、③溶液混合后pH=7,消耗溶液的体积:②>③
C. 将等体积的①、②溶液分别与足量铝粉反应,生成H2的量①更多
D. 分别向等体积的四种溶液中加水稀释至100 mL后,溶液的pH:③>④>①>②
难度: 困难查看答案及解析
-
对于溶液的酸碱性说法正确的是
A.使甲基橙变黄色的溶液一定呈碱性 B.pH等于7的溶液一定呈中性
C.c(H+)=c(OH-)的溶液一定呈中性 D.不能使酚酞试液变红的溶液一定呈酸性
难度: 简单查看答案及解析