-
O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。
T/℃
t/min
pH
3.0
4.0
5.0
6.0
20
301
231
169
58
30
158
108
48
15
50
31
26
15
7
据表中的递变规律,推测O3分别在条件①40℃、pH=3.0,②10℃、pH=5.0,③30℃、pH=7.0下,分解速率依次增大的顺序为
A. ①②③ B. ③②① C. ②①③ D. ③①②
难度: 中等查看答案及解析
-
室温下,下列各组离子在指定溶液中能大量共存的是
A.0.1 mol·L-1 NaOH溶液:Na+、K+、CO32-、AlO2-
B.0.1 mol·L-1 FeCl2溶液:K+、Mg2+、SO42-、MnO4-
C.0.1 mol·L-1 K2CO3溶液:Na+、Ba2+、Cl-、OH-
D.0.1 mol·L-1 H2SO4溶液:K+、NH4+、NO3-、HSO3-
难度: 简单查看答案及解析
-
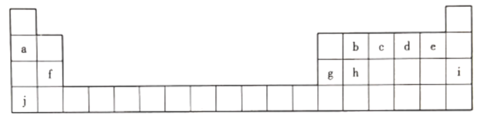
根据表1信息,判断以下叙述正确的是( )
表1 部分短周期元素的原子半径及主要化合价
元素代号
L
M
Q
R
T
原子半径/nm
0.160
0.143
0.112
0.104
0.066
主要化合价
+2
+3
+2
+6、-2
-2
A.氢化物的沸点为H2T<H2R B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性 D.L2+与R2-的核外电子数相等
难度: 中等查看答案及解析
-
下列图示的能量转化方式错误的是
A
B
C
D
图示

太阳能热水器

燃气燃烧

干电池工作

叶绿素光合作用
能量转化方式
太阳能转化为热能
化学能转化为热能、光能
电能转化为化学能
太阳能转化为化学能
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
铁铝榴石颜色深红,是宝石界中最常见的石榴子石,其化学成分为Fe3Al2( SiO4)3铁铝榴石中所含元系不属于短周期元素的是
A.Al B.Fe C.Si D.O
难度: 简单查看答案及解析
-
化学上存在许多的递变关系,下列递变关系完全正确的是
A.原子半径:Na>Mg>Al>Cl;离子半径:Na+>Mg2+>Al3+>Cl-
B.稳定性:HF>HCl>HBr>HI;还原性:HF>HCl>HBr>HI
C.熔沸点:Li>Na>K>Rb;金属性:Li>Na>K>Rb
D.酸性:HClO4>H2SO4>H2CO3;非金属性Cl>S>C
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示的物质间转化一步均能实现的是
A.NaCl(aq)
Cl2(g)
FeCl2(s)
B.MgCl2(aq)
Mg(OH)2(s)
MgO(s)
C.S(s)
SO3(g)
H2SO4(aq)
D.N2(g)
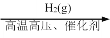 NH3(g)
NH3(g)NO2(g)
难度: 中等查看答案及解析
-
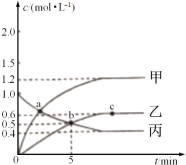
H2O2可用于羊毛、生丝、纸浆等的漂白。5% H2O2溶液在常温下分解速率很慢,为了加快H2O2分解,改变某一条件,下列装置与改变的条件相对应的是

A.甲一温度、乙一浓度 、丙一催化剂 B.甲一浓度、乙一 催化剂、丙一 温度
C.甲一催化剂、乙一温度 、丙一浓度 D.甲一温度、乙一催化剂、丙一浓度
难度: 中等查看答案及解析
-
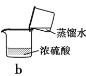
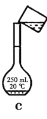
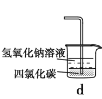
下列实验能达到实验目的的是
A.用装置a加热分解NaHCO3固体

B.按装置b把浓硫酸稀释为稀硫酸
C.按装置c把溶液转移入容量瓶
D.用装置d吸收尾气中的氯气与氯化氢
难度: 中等查看答案及解析
-
下列根据反应Zn +Cu2+ =Zn2+ + Cu设计的原电池不符合该反应的是
A.
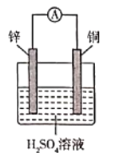 B.
B.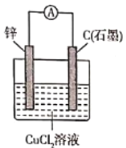
C.
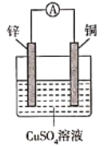 D.
D.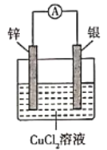
难度: 中等查看答案及解析
-
下列说法正确的是
A.放热过程均发生化学反应
B.周期表中第13列元素均为金属元素
C.在过渡元素中可寻找催化剂和耐高温、耐腐蚀的合金材料
D.合成氨反应达到平衡时,正、逆反应速率相等且均为0
难度: 中等查看答案及解析
-
已知反应:NO2(g) + SO2(g)
SO3(g) + NO(g) ,起始时向某密闭容器中通入1 mol NO2 、 2 mol S18O2,.反应达到平衡后,下列有关说法正确的是:
A.NO2中不可能含18O B.有1 mol N18O生成
C.S18O2的物质的量不可能为0. 8 mol D.SO2、SO3、NO、NO2均含18O时,说明该反应达到平衡
难度: 困难查看答案及解析
-
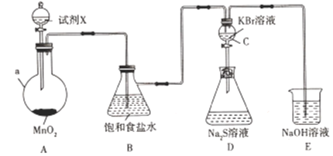
研究人员发现了一种利用淡水与海水之间含盐量差别进行发电的“水”电池,总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。下列说法正确的是( )
A. 正极反应式:Ag+Cl--e-=AgCl B. 每生成1mol Na2Mn5O10转移的电子数为2NA
C. Na+不断向“水”电池的负极移动 D. AgCl是还原产物
难度: 中等查看答案及解析
-
用锌粒与2mol·L-1的稀硫酸混合制备氢气时,若向其中分别再加入少量等体积的下列物质:①KCl溶液、②4mol·L-1盐酸、③CuC12溶液、④4mol·L-1CH3COONa溶液,则加入后反应生成氢气速率的大小顺序是
A.③>④>① B.①>②>④
C.②>①>④ D.④>③>②
难度: 中等查看答案及解析
-
科学家利用回旋加速器,用钙原子轰击钚原子得到了鈇元素,半衰期达30秒。下列有关说法错误的是
A.鈇元素的相对原子质量是289
B.鈇元素属于过渡元素
C.鈇元素是放射性元素
D.鈇元素的主要化合价有+4、+2
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值。下列说法正确的是
A.15g14CO与15N2的混合气体所含质子数为7.5NA
B.11.2LCl2与NaOH溶液反应转移电子数为0.5NA
C.2molSO2与1mol02反应生成SO3的分子数为2NA
D.48gO2和O3的混合气体中含有3NA个氧原子
难度: 中等查看答案及解析
-
下列说法中正确的是
①离子化合物中一定有离子键,可能有共价键
②NaHSO4固体中阳离子和阴离子的个数比是1:1
③非金属单质中一定不含离子键,一定只含共价键
④氯化氢溶于水断裂共价键,故过程为化学变化
⑤熔融AlCl3不导电,所以AlCl3是非电解质
⑥非极性键可能存在于非金属单质中,也可能存在于离子化合物或共价化合物中
A.①④⑤ B.①③④⑥ C.①⑥ D.①②⑥
难度: 中等查看答案及解析
-
一种镁-过氧化氢燃料电池的原理为Mg + H2O2 + H2SO4=MgSO4+ 2H2O ,其装置如图所示。下列说法错误的是
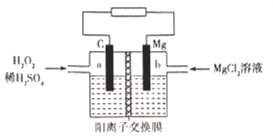
A.a极发生还原反应 B.电子由b极经电解质溶液流向a极
C.Mg2+由右侧经过阳离子交换膜移向左侧 D.b极电极反应式为Mg-2e-=Mg2+
难度: 中等查看答案及解析
-
四种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。下列说法中正确的是
X
Y
Z
W
A.Y的氢化物一定属于电解质
B.YO2是一种有毒气体,属于酸性氧化物
C.Z的最简单氢化物比Y的最简单氢化物稳定性更强
D.XW2中各原子最外层均达到8e-稳定结构
难度: 中等查看答案及解析
-
X、Y、Z三种短周期元素,原子半径的大小关系为r(Y)>r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质在适当的条件下可发生如图所示的变化,其中A为X、Y组成的双原子分子,B和C均为10电子分子。下列说法不正确的是
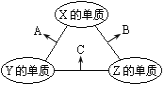
A.X元素位于第ⅥA族 B.A不能溶于B中
C.A和C不可能发生氧化还原反应 D.C溶于B形成的溶液呈碱性
难度: 困难查看答案及解析