-
氦-3聚变(3He+3He→4He+2H)可作为未来可控核聚变的清洁能源,下列说法正确的是
A.氦-3聚变属于化学变化 B.3He和4He具有相同的质量数
C.He位于第1周期第ⅡA族 D.2H和3He具有相同的中子数
难度: 简单查看答案及解析
-
下列物质中不含化学键的是
A.Si B.S C.Ar D.Fe
难度: 简单查看答案及解析
-
下列有关海洋资源的利用,未涉及氧化还原反应的是
A.海水提溴 B.海水淡化 C.氯碱工业 D.海带提碘
难度: 简单查看答案及解析
-
不能用于杀菌消毒试剂的是
A.75%酒精 B.3%双氧水 C.漂粉精 D.食醋
难度: 中等查看答案及解析
-
下列反应与酸雨的形成无关的是
A.CO2+H2O⇌H2CO3 B.SO3+H2O=H2SO4
C.2H2SO3+O2=2H2SO4 D.N2+O2
2NO
难度: 简单查看答案及解析
-
聚丙烯是生产医用口罩最核心的材料,下列有关聚丙烯的说法正确的是
A.属于纯净物
B.单体为CH3—CH=CH2,可以通过石油裂解获取
C.结构简式为
D.所有碳原子一定共面
难度: 中等查看答案及解析
-
关于化合物2—苯基丙烯(
),下列说法正确的是
A.不能使稀酸性高锰酸钾溶液褪色 B.与甲苯互为同系物
C.最多能与4molBr2发生加成反应 D.与
互为同分异构体
难度: 中等查看答案及解析
-
铁粉、食盐、炭粉等混合常作为食品脱氧剂,下列有关说法正确的是
A.脱氧剂工作原理是将电能转化为化学能
B.食盐可以加速包装袋中氧气的吸收
C.铁最终被氧化为Fe(OH)2
D.炭粉上发生的电极反应为:O2+4e-=2O2-
难度: 中等查看答案及解析
-
有关酸碱滴定实验,下列说法的正确的是
A.滴定管和锥形瓶都需要使用蒸馏水和待装液润洗
B.滴定前,必须将滴定管中液体的液面调至0刻度
C.滴定至终点时,溶液一定呈中性
D.测定待测液的浓度,至少需要完成两组平行实验,取消耗标准液的平均值
难度: 中等查看答案及解析
-
将一定量的SO2通入Fe(NO3)3溶液中,再加入适量BaCl2溶液,一定会大量增加的是
A.H+ B.SO42- C.Ba2+ D.Fe2+
难度: 中等查看答案及解析
-
化学实验常对“纸”进行湿润,以下说法正确的是
A.用湿润的pH试纸测定某酸溶液的pH
B.用湿润的淀粉碘化钾试纸检验氯气
C.过滤时,先将滤纸湿润,然后再将滤纸放入漏斗中
D.用湿润的红色石蕊试纸检验浓盐酸的挥发性
难度: 简单查看答案及解析
-
25℃、101kPa时,能量转化如图,下列说法正确的是
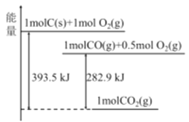
A.热化学方程式2CO(g)+O2(g)=2CO2(g)+282.9kJ
B.CO2是由极性键构成的极性分子
C.1molC(s)与1molCO2(g)生成2molCO(g)反应为放热反应
D.相同条件下,1molC(s)和0.5molO2(g)总能量高于1molCO(g)的能量
难度: 中等查看答案及解析
-
向含有水分的蔗糖中缓慢注入浓硫酸,不能显示浓硫酸的
A.酸性 B.吸水性 C.脱水性 D.氧化性
难度: 简单查看答案及解析
-
关于NH4NO3的说法正确的是
A.属于共价化合物 B.溶于水放热
C.既属于铵态氮肥也属于硝态氮肥 D.属于弱电解质
难度: 简单查看答案及解析
-
胆矾的结晶水含量测定实验,恒重操作用不到的仪器是
A.
B.
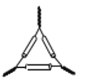 C.
C.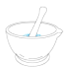 D.
D.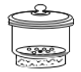
难度: 简单查看答案及解析
-
如图为乙酸丁酯制备的实验装置,下列说法正确的是
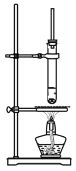
A.玻璃导管的主要作用是平衡试管内外压强
B.该装置适用于乙酸乙酯的制备
C.加入过量乙酸可以提高丁醇的转化率
D.分离提纯乙酸丁酯的方法是将混合物直接分液
难度: 简单查看答案及解析
-
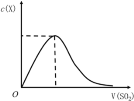
一定条件下,向体积为1L的密闭容器中充入1molCO2和4molH2,测得CO2和CH3OH(g)的浓度随时间的变化如图所示。下列叙述中正确的是

A.该反应的化学方程式为:CO2(g)+4H2(g)⇌2CH3OH(g)
B.10min时,反应停止
C.2min时,CO2的消耗速率等于CH3OH的消耗速率
D.从反应开始到平衡,H2的平均反应速率v(H2)=0.225mol/(L·min)
难度: 中等查看答案及解析
-
去除括号内少量杂质,选用的试剂和方法正确的是
A.酒精(碘):加氢氧化钠溶液,分液 B.CO2(SO2):通入饱和碳酸氢钠溶液,洗气
C.Fe2O3(Al2O3):加氨水,过滤 D.乙酸(乙醛):加新制氢氧化铜,加热,过滤
难度: 中等查看答案及解析
-
下列化学与生产.生活相关的说法正确的是
A.生铁、青铜等合金比纯金属耐腐性强
B.石油主要由各种烃组成的混合物,可以通过分馏的方法分离出C8H18
C.分离工业合成氨产品的方法是将氨气液化
D.氨的催化氧化的适宜条件为高温、高压、催化剂
难度: 中等查看答案及解析
-
常温下向某浓度的氯水中逐滴滴入Na2SO3溶液,无气体逸出,溶液pH变化如图所示,下列关系正确的是
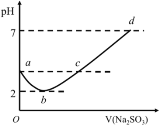
A.a点:c(H+)>c(Cl-)>c(ClO-)
B.b点:c(Cl-)=c(SO42-)=0.005mol·L-1
C.c点:c(Na+)=2c(HSO3-)+2c(SO32-)+2c(SO42-)
D.d点:c(Na+)=c(Cl-)+2c(SO32-)+2c(SO42-)
难度: 中等查看答案及解析
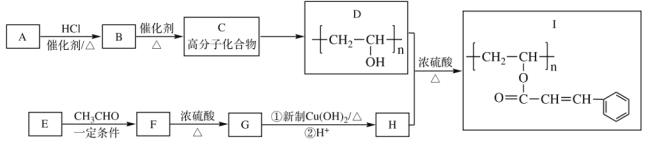
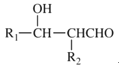
 B
B 目标产物)___________________
目标产物)___________________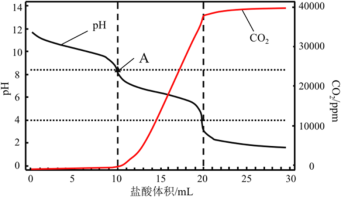 。
。