-
有五种元素X、Y、Z、Q、T。X元素为主族元素,X原子的M层上有两个未成对电子且无空轨道;Y原子的特征电子构型为3d64s2;Z原子的L电子层的p能级上有一个空轨道;Q原子的L电子层的P能级上只有一对成对电子;T原子的M电子层上p轨道半充满。下列叙述不正确的是
A. 元素Y和Q可形成化合物Y2Q3
B. X与T的最高价氧化物对应的水化物,前者的酸性比后者强,是因为前者的非羟基氧原子数目大于后者
C. X和Q结合生成的化合物为离子化合物
D. ZQ2是极性键构成的非极性分子
难度: 中等查看答案及解析
-
原子最外层电子排布式为ns2的元素有很多种,下列对该元素的推测不正确的是
A. 该元素可能与IA族某种元素性质相似
B. 该元素的单质、氧化物、氢氧化物可能都与NaOH溶液反应
C. 该元素原子中可能有未成对电子
D. 该元素原子的得电子能力可能很强
难度: 简单查看答案及解析
-
氨分子、水分子、甲烷分子中共价键的键角分别为a、b、c,则a、b、c的大小关系为
A. a<b<c B. c<b<a
C. b<c<a D. b<a<c
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A. ABn型分子中,若中心原子没有孤对电子,则ABn为空间对称结构,属于非极性分子
B. 水很稳定是因为水中含有大量的氢键所致
C. H2O、NH3、CH4分子中的O、N、C分别形成2个、3个、4个键,故O、N、C原子分别采取sp、sp2、sp3 杂化
D. 配合物[Cu(H2O)4]SO4中,中心离子是Cu2+,配位体是SO42-,配位数是1
难度: 中等查看答案及解析
-
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4; ②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是
A. 第一电离能:③>②>① B. 原子半径:③>②>①
C. 电负性:③>②>① D. 最高正化合价:③>②>①
难度: 简单查看答案及解析
-
已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是
A.质子数c>d,离子的还原性Y2->Z-
B.氢化物的稳定性H2Y>HZ
C.原子半径X<W,第一电离能X<W
D.电负性Z>Y>W>X
难度: 中等查看答案及解析
-
区分晶体和非晶体的最科学的方法是
A.测固体的熔点 B.看固体是否易被压缩
C.对固体进行X射线衍射实验 D.比较固体的导热性
难度: 简单查看答案及解析
-
下列说法错误的是
A. 卤化氢中,以HF沸点最高,是由于HF分子间存在氢键
B. 邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点低
C. H2O的沸点比HF的沸点高,是由于水分子内氢键键能大
D. 氢键X-H…Y的三个原子不一定在一条直线上
难度: 简单查看答案及解析
-
下列物质性质的变化规律与键能无关的是
①HF、HCl、HBr、HI的热稳定性依次减弱
②NH3易液化
③F2、Cl2,Br2、I2的熔、沸点逐键升高
④H2S的熔,涕点小于H2O的熔、沸点
⑤NaF、NaCl、NaBr、NaI的熔点依次降低
A. ①③④ B. ③④⑤ C. ②③④ D. ①②③④⑤
难度: 简单查看答案及解析
-
下列表达式错误的是( )
A.甲烷的电子式:
B.氮原子的L层电子轨道表示式:
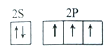
C.硫离子的核外电子排布式: ls22s22p63s23p4
D.碳—12原子:126C
难度: 简单查看答案及解析
-
下列现象不能用“相似相溶”解释的是
A.氯化氢易溶于水 B.用CCl4萃取碘水中的碘
C.氯气易溶于NaOH溶液 D.苯与水混合静置后分层
难度: 简单查看答案及解析
-
A元素的阳离子与B元素的阴离子具有相同的电子层结构,有关两元素的下列叙述:
①原子半径A<B;②离子半径A>B;③原子序数A>B;④原子最外层电子数A<B;⑤A 的正价与B的负价绝对值一定相等;⑥A的电负性小于B的电负性;⑦A的第一电离能大于B的第一电离能。其中正确的组合是
A. ①②⑦ B. ③④⑥ C. ③⑤ D. ③④⑤⑥⑦
难度: 中等查看答案及解析
-
下列描述中正确的是
A. NO3-的空间构型为三角锥形
B. SiF4和SO32-的中心原子均为sp3杂化
C. 在所有的元素中,氟的第一电离能最大
D. C2H5OH分子中共含有8个极性键,1个π键
难度: 简单查看答案及解析
-
美国科学家合成了含有N5+的盐类,含有该离子的盐是高能爆炸物质,该离子的结构呈V 形,如图所示(图中箭头代表单键)。下列有关该物质的说法中正确的是
A.每个Ns+中含有35个质子和36个电子 B.该离子中只含有非极性键
C.该离子中含有2个π键 D.
与
互为等电子体
难度: 中等查看答案及解析
-
下列各组分子中,都属于含极性键的非极性分子的是
A.CO2 H2S B.C2H4 BF3 C.C60 C2H4 D.NH3 HCl
难度: 简单查看答案及解析
-
下列关于分子晶体的说法正确的是
A.晶体中分子间作用力越大,分子越稳定
B.在分子晶体中一定存在共价键
C.冰和Br2都是分子晶体
D.稀有气体不能形成分子晶体
难度: 简单查看答案及解析
-
下列说法正确的是 ( )
A.π键是由两个p轨道“头碰头”重叠形成的
B.σ键就是单键,π键就是双键
C.乙烷分子中的键全为σ键,而乙烯分子中含σ键和π键
D.H2分子中含σ键,而Cl2分子中含π键
难度: 简单查看答案及解析
-
下列表达方式正确的是
A.24 Cr的外围电子排布式:3d44s2
B.CO2的立体结构模型
C.基态碳原子的价电子排布图为
D.S2-的结构示意图:
难度: 简单查看答案及解析
-
已知C3N4晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合。下列关于C3N4晶体的说法错误的是
A.该晶体属于原子晶体,其熔、沸点很高
B.该晶体中每个碳原子上连有4个氮原子,每个氮原子连接3个碳原子
C.该晶体中碳原子和氮原子都满足最外层8电子结构
D.该晶体的结构与金刚石类似,都是原子间以非极性键形成的空间网状结构
难度: 中等查看答案及解析