-
有A、B、C、D、E五种原子序数增大的元素,只有一种为金属。A、B、C均为第二周期紧邻元素,其第一电离能顺序为B>C>A;B与D同主族;E为第4周期副族元素,其价层电子为全满。
(1)E元素的名称为________,该元素基态原子的价电子排布式为_______。
(2)B与D分别与氢形成最简单氢化物沸点高低顺序为____(用化学式表示);原因_____。
(3)A、B、C三种元素分别与氢形成化合物中的M-M(M代表A、B、C)单键的键能如下表:

上述三种氢化物中,A、B、C元素原子的杂化方式有_____种;请解释上表中三种氢化物M-M单键的键能依次下降的原因______________________。
(4)D与氯形成的化合物DC15,加压条件下148℃液化,发生完全电离得到一种能够导电的熔体,测定D-Cl键长为198pm和206pm两种,该熔体中含有一种正四面体结构的阳离子,请写出该条件下DC15电离的电离方程式__________;该熔体中阴离子的空间构型为________。
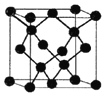
(5)E与C形成的化合物晶体结构有四种,其中一种与金刚石类似,金刚石晶体结构如图所示,该晶体的化学式为______(用元素符号表示);该晶胞的棱长为apm 则该晶体的密度为______g/cm3。
-
X、Y、Z、W、N为前四周期五种元素,分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X、Y、Z的氢化物都比同族元素氢化物的沸点高。N原子外围未成对电子数是同周期中最多的。W元素的电离能数据见下表(kJ·mol-1):
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
请回答:
(1)W2Y2含有的电子式为 ________。灼烧W2Y2时,火焰呈特殊颜色,请从原理上解释产生该现象的原因:________。
(2)N元素基态原子的外围电子排布式是:________。
(3)X3-的空间构型是________,中心原子的杂化方式是________。
(4)用氢键表示式写出Z的氢化物水溶液中存在的氢键 ________ ________。
-
X、Y、Z、W、N为前四周期的五种元素,分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X、Y、Z的氢化物都比同族元素氢化物的沸点高。N原子外围未成对电子数是同周期中最多的。W元素的电离能数据见下表(kJ·mol-1):
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
请回答:
(1)W2Y2含有的电子式为______________。灼烧W2Y2时,火焰呈特殊颜色,请从原理上解释产生该现象的原因:________________________________________。
(2)N元素基态原子的外围电子排布式是:___________________________。
(3)X3-的空间构型是_________________,中心原子的杂化方式是__________。
(4)用氢键表示式写出Z的氢化物水溶液中存在的氢键_________________。
-
A、B、C、D、E为前四周期元素,且原子序数依次增大
| A | 第二周期中一种非金属元素,第一电离能大于相邻元素 |
| B | 地壳中含量最多的元素,2P轨道上有二个孤电子 |
| C | 与B同主族 |
| D | 前四周期中金属性最强的元素 |
| E | 前四周期中原子核外孤电子数最多 |
(1)C元素位于第__________________周期__________________族,B元素的核外电子排布式为__________________,E元素的价电子排布图为__________________。
(2)B、C两元素的电负性大小关系为:__________________(用元素符号表示),A、B的最简单气态氢化物的稳定性强弱大小关系为:________________(用氢化物的化学式表示)。
(3)B的氢化物由固体变为气态所需克服的微粒间的作用有__________________。
(4)有A、B、C三种元素及氢元素组成的既含离子键又含共价键且其中元素C显最高价的酸式盐的化学式是__________________。
(5)D2B2的电子式为__________________,与CO2反应生成B的单质的化学方程式为:__________________。
(6)E2O72-具有强氧化性,可与含有C元素的某种还原性离子反应(该离子中C元素显+4价),在酸性条件下该反应的离子方程式为:__________________
-
下列说法中正确的是
A.第3周期的元素中,钠的第一电离能最大
B.最外层都只有一个电子的两原子的性质一定完全相同
C.元素电负性越大的原子,吸引电子的能力越强
D.在同一周期中,随着原子序数的增大,元素的电负性逐渐减小
-
短周期主族元素X、Y、Z、W 原子序数依次增大,X是地壳中含量最多的元素,Y原子的最外层只有一个电子,Z的简单离子半径同周期中最小, W 的价电子数是Z的2倍。下列说法正确的是( )
A.第一电离能:W>Z>Y>X
B.由Y 、W组成的化合物的水溶液呈碱性的原因:W2-+2H2O H2W+2OH-
H2W+2OH-
C.Z的最高价氧化物的水化物的碱性比Y的强
D.由 Z、W 组成的化合物不能在水溶液中制备
-
元素周期表中电负性最大的元素是 ,最小的是 。(放射性金属除外);第二、三、四周期原子中p轨道半充满的元素是 ;最活泼的金属元素是 (放射性元素除外);最活泼的非金属元素是 ;在第三周期中,第一电离能最小的元素是 ,第一电离能最大的元素是 ;写出第二周期第ⅥA主族元素原子核外的电子排布式 。
-
下列说法正确的是
A.ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
B.ⅠA族元素的金属性比ⅡA族元素的金属性强
C.第二周期元素从左到右第一电离能依次增大
D.第三周期元素的离子半径从左到右逐渐减小
-
下列有关说法中正确的是
A.第一电离能越大的原子越容易得到电子
B.同周期元素从左到右第一电离能一定增大
C.同周期元素电负性从左到右越来越大
D.金属元素的电负性一定小于非金属元素
-
有五种短周期主族元素 X、 Y、 Z、 R、Q, 它们的原子序数逐渐增大,其中X、 Y、 R、Q在周期表中位置如图;R的简单离子半径是同周期中最小的;Z是组成叶绿素的金属元素,其原子的第一至第四电离能分别是: I1=738kJ/mol I2 = 1451 kJ/mol I3 = 7733kJ/mol
I4 = 10540kJ/mol。下列说法正确的是( )
A. 工业上都用电解它们的氧化物方法制Z、R、Q单质
B. X和Y 的单质熔点: X<Y
C. 第一电离能:Q> R > Z
D. Y的简单氢化物可与盐酸反应生成既有离子键又有共价键和配位键的化合物

