-
工业上获得大量乙烯、丙烯、丁二烯的方法是( )
A.卤代烃消除 B.煤高温干馏 C.炔烃加成 D.石油裂解
难度: 简单查看答案及解析
-
分类是重要的科学研究方法,下列物质分类错误的是
A.电解质:明矾、碳酸、硫酸钡 B.酸性氧化物:SO3、CO2、NO
C.混合物:铝热剂、矿泉水、焦炉气 D.同素异形体:C60、C70、金刚石
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是( )
A.二氧化碳分子的比例模型
B.芳香烃的组成通式 CnH2n﹣6(n≥6)
C.12C、14C原子结构示意图均可表示为
D.羟基的电子式
难度: 中等查看答案及解析
-
第三周期元素的原子中,未成对电子不可能有( )
A.4个 B.3个 C.2个 D.1个
难度: 简单查看答案及解析
-
氮化硅是一种高温陶瓷材料,其硬度大、熔点高,下列晶体熔化(或升华)时所克服的微粒间作用力都与氮化硅相同的是( )
A.白磷、硅 B.碳化硅、硫酸钠
C.水晶、金刚石 D.碘、汞
难度: 中等查看答案及解析
-
实验室可用浓盐酸与浓硫酸混合快速制取HCl.下列解释合理的是( )
A.浓硫酸是高沸点的酸,通过它与浓盐酸反应制取低沸点的酸
B.通过改变温度和浓度等条件,利用平衡移动原理制取HCl
C.两种强酸混合,溶解度会相互影响,低溶解度的物质析出
D.浓硫酸的浓度远大于浓盐酸的浓度,高浓度的酸制取低浓度的酸
难度: 中等查看答案及解析
-
下列生产、生活中的事实不能用金属活动性顺序表解释的是( )
A.铝制器皿不宜盛放酸性食物
B.电解饱和食盐水阴极产生氢气得不到钠
C.铁制容器盛放和运输浓硫酸
D.镀锌铁桶镀层破损后铁仍不易被腐蚀
难度: 中等查看答案及解析
-
下列物质的制备中,不符合工业生产实际的是( )
A.NH3
NO
NO2
HNO3
B.浓缩海水
Br2
HBr
Br2
C.饱和食盐水
Cl2
漂白粉
D.H2和Cl2混合气体
HCl气体
盐酸
难度: 中等查看答案及解析
-
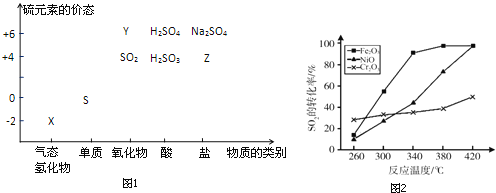
如图是部分短周期元素原子半径与原子序数的关系图。字母代表元素,分析正确的是
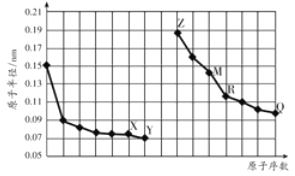
A.R在周期表的第15列
B.Y、Q两种元素的气态氢化物及其最高价氧化物的水化物均为强酸
C.简单离子的半径:X>Z>M
D.Z的单质能从M与Q元素构成的盐溶液中置换出单质M
难度: 中等查看答案及解析
-
室温下用下列装置进行相应实验,能达到实验目的的是
A.
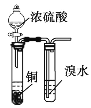 验证浓硫酸具有强氧化性 B.
验证浓硫酸具有强氧化性 B.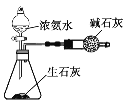 制取干燥的NH3
制取干燥的NH3C.
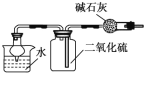 干燥、收集并吸收多余的SO2 D.
干燥、收集并吸收多余的SO2 D.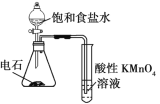 验证乙炔的还原性
验证乙炔的还原性难度: 中等查看答案及解析
-
等温等压下,有质子数相等的CO、N2、C2H2三种气体,下列叙述中正确的是( )
A. 体积之比为13∶13∶14 B. 密度之比为14∶14∶13
C. 质量之比为1∶1∶1 D. 原子数之比为1∶1∶1
难度: 中等查看答案及解析
-
下列有关钢铁腐蚀与防护的说法不正确的是
A.生铁比纯铁容易生锈
B.钢铁的腐蚀生成疏松氧化膜,不能保护内层金属
C.钢铁发生吸氧腐蚀时,正极反应式为:O2+2H2O+4e-== 4OH-
D.为保护地下钢管不受腐蚀,可使其与直流电源正极相连
难度: 中等查看答案及解析
-
将足量SO2气体通入下列各组溶液中,所含离子还能大量共存的是( )
A.Ba2+、Ca2+、Br﹣、Cl﹣ B.CO32﹣、SO32﹣、K+、NH4+
C.Na+、NH4+、I﹣、HS﹣ D.Na+、Ca2+、ClO﹣、NO3﹣
难度: 中等查看答案及解析
-
一定条件下,CO2分子晶体可转化为具有类似SiO2结构的原子晶体.从理论上分析,下列说法正确的是( )
A.该转化过程是物理变化
B.1molCO2原子晶体中含2mol C﹣O键
C.CO2原子晶体的熔点高于SiO2
D.CO2的原子晶体和分子晶体互为同分异构体
难度: 中等查看答案及解析
-
下列实验不能达到预期目的是( )
实验操作
实验目的
A
充满NO2的密闭玻璃球分别浸泡在冷、热水中
研究温度对化学平衡移动的影响
B
向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀,再向其中滴加Na2S溶液
说明一种沉淀能转化为另一种溶解度更小的沉淀
C
苯酚和水的浊液中,加少量浓碳酸钠溶液
比较苯酚与碳酸氢钠的酸性
D
取少量溶液滴加Ca(OH)2溶液,观察是否出现白色浑浊
确定NaHCO3溶液中是否混有Na2CO3
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
将1mol过氧化钠与2mol碳酸氢钠固体混合,在密闭容器中,120℃充分反应后,排出气体,冷却,有固体残留.下列分析正确的是( )
A.残留固体是2mol Na2CO3
B.残留固体是 Na2CO3和NaOH的混合物
C.反应中转移2mol电子
D.排出的气体是1.5mol氧气
难度: 困难查看答案及解析
-
饱和食盐水中加入碳酸氢铵可制备小苏打,滤出小苏打后,向母液中通入氨,再冷却、加食盐,过滤,得到氯化铵固体.下列分析错误的是( )
A.该制备小苏打的方程式为:NaCl+NH4HCO3→NaHCO3↓+NH4Cl
B.母液中通入的氨气与HCO3﹣反应:NH3+HCO3﹣→CO32﹣+NH4+
C.加食盐是为增大溶液中Cl﹣的浓度
D.由题可知温度较低时,氯化铵的溶解度比氯化钠的大
难度: 中等查看答案及解析
-
铜锡合金,又称青铜,含锡量为
~
(质量比)的青铜被称作钟青铜,有一铜锡合金样品,可通过至少增加a g锡或至少减少b g铜恰好使其成为钟青铜,增加ag锡后的质量是减少bg铜后质量的2倍.则原铜锡合金样品中铜锡的质量之比为( )
A.7:17 B.3:2 C.12:1 D.7:1
难度: 中等查看答案及解析