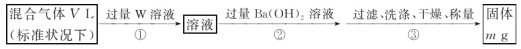-
下列电子排布式表示的基态原子中,第一电离能最小的是
A.ns2np3 B.ns2np5 C.ns2np4 D.ns2np6
难度: 简单查看答案及解析
-
2019 年 12 月 27 日晚,长征五号运载火箭“胖五”在海南文昌航天发射场成功将实践二十号卫星送入预定轨道。下列有关说法正确的是
A.胖五”利用液氧和煤油为燃料,煤油为纯净物
B.火箭燃料燃烧时将化学能转化为热能
C.火箭箭体采用铝合金是为了美观耐用
D.卫星计算机芯片使用高纯度的二氧化硅
难度: 简单查看答案及解析
-
下列装置或操作能达到相应实验目的的是
A.
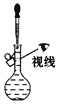 配制一定浓度的 NaCl 溶液 B.
配制一定浓度的 NaCl 溶液 B.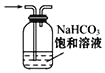 除去 SO2 中的 HCl
除去 SO2 中的 HClC.
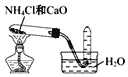 实验室制取氨气 D.
实验室制取氨气 D.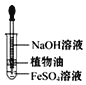 观察 Fe(OH)2 的生成
观察 Fe(OH)2 的生成难度: 简单查看答案及解析
-
向淀粉-碘化钾的酸性溶液中加入少量 H2O2 溶液,溶液立即变蓝,再向蓝色溶液中缓慢通入足量的 SO2, 蓝色逐渐消失。下列判断不正确的是
A.根据上述实验判断 H2O2 和 SO2 反应能生成强酸
B.蓝色逐渐消失,体现了 SO2 的漂白性
C.SO2 中 S 原子采取 sp2杂化方式,分子的空间构型为 V 型
D.H2O2是一种含有极性键和非极性键的极性分子
难度: 简单查看答案及解析
-
设 NA 表示阿伏加德罗常数的数值,下列叙述正确的是
A.将 1 mol NH4NO3 溶于适量稀氨水中,所得溶液呈中性,则溶液中 NH4 +的数目为 NA
B.1.7 g H2O2 中含有的电子数为 0.7NA
C.标准状况下,2.24 L 戊烷所含分子数为 0.1NA
D.1 mol Na 与足量 O2 反应,生成 Na2O 和 Na2O2 的混合物,钠失去 2NA 个电子
难度: 简单查看答案及解析
-
亚硝酰氯(NOCl)是有机物合成中的重要试剂,为红褐色液体或黄色气体,室温下为不稳定的黄色气体, 具刺鼻恶臭味,遇水分解,某学习小组用 C12 和 NO 制备 NOCl 装置如图。下列说法错误的是

A.氯气在反应中做氧化剂
B.装入药品后,要先打开 K2、K3,反应一段时间后,再打开 K1
C.利用 A 装置还可以做 Na2O2 和水制氧气的实验
D.若没有 B 装置,C 中可能发生反应:2NOCl+H2O=2HCl+NO↑+NO2↑
难度: 中等查看答案及解析
-
某种化合物(如图)由 W、X、Y、Z 四种短周期元素组成,其中 W、Y、Z 分别位于三个不同周期,Y 核外最外层电子数是 W 核外最外层电子数的二倍;W、X、Y 三种简单离子的核外电子排布相同。下列说法不正确的是
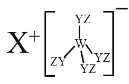
A.原子半径:W < X < Y < Z
B.X 与 Y、Y 与 Z 均可形成具有漂白性的化合物
C.简单离子的氧化性: W X
D.W 与 X 的最高价氧化物的水化物可相互反应
难度: 中等查看答案及解析
-
下列实验中根据现象得出的结论错误的是( )
选项
实验
现象
结论
A
相同条件下,用1mol·L-1的CH3COOH和1mol·L-1的HCl分别做导电性实验
CH3COOH溶液对应的灯泡较暗
CH3COOH是弱电解质
B
向某溶液中加铜和浓H2SO4
试管口有红棕色气体产生
原溶液可能含有NO3-
C
向某钠盐中滴加浓盐酸,将产生的气体通入品红溶液
品红溶液褪色
该钠盐为Na2SO3或NaHSO3
D
向浓度均为0.1 mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水
先出现蓝色沉淀
Ksp[Mg(OH)2]>
Ksp[Cu(OH)2]
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
已知磷酸分子(
)中的三个氢原子都可以与重水分子(D2O)中的 D 原子发生氢交换。又知次磷酸( H3 PO2)也可与 D2O 进行氢交换,但次磷酸钠(NaH2PO2)却不能与 D2O 发生氢交换。下列说法正确的是
A.H3 PO2 属于三元酸 B.NaH2PO2 溶液可能呈酸性
C.NaH2PO2 属于酸式盐 D.H3 PO2 的结构式为
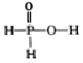
难度: 简单查看答案及解析
-
关于下列转化过程分析不正确的是

A.Fe3O4 中 Fe 元素的化合价为+2、+3
B.过程Ⅰ中每消耗 58 g Fe3O4 转移 1 mol 电子
C.过程Ⅱ的化学方程式为 3FeO+H2O
Fe3O4+H2↑
D.该过程总反应为 2H2O═2H2↑+O2↑
难度: 简单查看答案及解析
-
实验室用 NH4Cl、盐酸、NaClO2 为原料制备 ClO2 的过程如下图所示,下列说法不正确的是

A.X 中大量存在的阴离子有 Cl-和 OH- B.NCl3 的键角比 CH4 的键角大
C.NaClO2 变成 ClO2 发生了氧化反应 D.制取 3 mol ClO2 至少需要 0.5mol NH4Cl
难度: 简单查看答案及解析
-
工业上常采用碱性氯化法来处理高浓度氰化物污水,发生的主要反应为:CN-+OH-+Cl2―→CO2+ N2+Cl-+H2O(未配平)。下列说法错误的是
A.Cl2 是氧化剂,CO2 和 N2 是氧化产物
B.该反应中,若有 1mol CN-发生反应,则有 5NA 电子发生转移
C.上述离子方程式配平后,氧化剂、还原剂的化学计量数之比为 2∶5
D.若将该反应设计成原电池,则 CN-在负极区发生反应
难度: 简单查看答案及解析
-
类比pH的定义,对于稀溶液可以定义pC=-lgC,pKa=-lgKa,常温下,某浓度H2A溶液在不同pH值下,测得pC(H2A)、pC(HA﹣)、pC(A2﹣)变化如图所示,下列说法正确的是
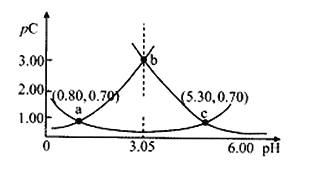
A.随着pH的增大,pC增大的曲线是A2﹣的物质的量浓度的负对数
B.pH=3.50时,c(HA﹣)> c(H2A) > c(A2﹣)
C.b点时c(H2A)·c(A2﹣)/c2(HA﹣)=10﹣4.5
D.pH=3.00~5.30时,c(H2A)+c(HA﹣)+c(A2﹣)先减小后增大
难度: 困难查看答案及解析



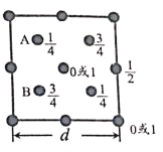 (d 的单位为 nm)
(d 的单位为 nm)