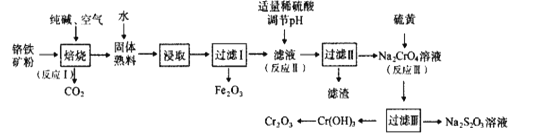
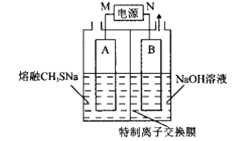
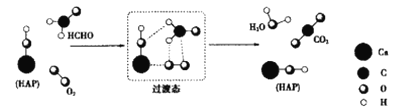
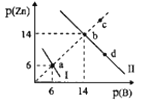
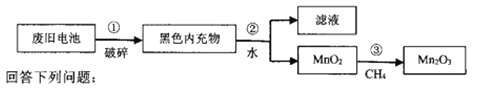
-
化学与生产和生活密切相关,下列说法正确的是( )
A.铁制品表面镀锡不能增强铁制品的抗腐蚀性
B.被Cu2+污染的水体可以用难溶的FeS进行治理
C.施用化肥时,将草木灰与氯化铵混合使用可增加肥效
D.世界能源大会将核能作为碳能源重要替代品,核电站能够把化学能转化为电能
难度: 简单查看答案及解析
-
下列有关描述及化学用语的表示方法正确的是( )
A.原子核内有8个中子的基态碳原子价电子排布图为:
B.NH4F的电子式为:
,三种元素中氟的第一电离能最大
C.铜属于d区元素,溴属于p区元素,二者基态原子未成对电子数目相同
D.CO2分子的结构式为:O=C=O,碳的原子半径大于氧的原子半径
难度: 简单查看答案及解析
-
X、Y、Z、M为原子序数递增的前10号元素,基态X原子的核外电子数目等于其电子层数,Y、Z、M三种元素相邻,基态Z原子核外未成对电子数目最多。下列说法正确的是( )
A.第一电离能:Y<M<Z
B.简单气态氢化物稳定性:Y>Z>M
C.电负性:M>Z>X>Y
D.原子半径:X<Y<Z<M
难度: 简单查看答案及解析
-
下列关于化学反应原理的说法正确的是( )
A.燃料电池可以将化学能完全转化为电能
B.可以根据相同条件下碱的电离常数的大小比较其碱性的强弱
C.可以用加热蒸发FeCl3稀溶液的方法得到FeCl3浓溶液
D.无法用溶度积常数小的固体来制备溶度积常数大的固体
难度: 中等查看答案及解析
-
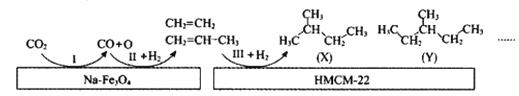
α-Fe(Ⅲ)铁原子簇是合成氨工业的新型高效催化剂,N2和H2在其表面首先变为活化分子,反应机理为:①H2(g)═2H(g) △H1,②N2(g)+2H(g)
2(NH)(g) △H2,③NH(g)+H(g)
(NH2) △H3,④(NH2)(g)+H(g)
NH3(g) △H4,总反应为N2(g)+3H2(g)
2NH3(g) △H。下列说法正确的是( )
A.△H═3△H1+△H2+2△H3+2△H4
B.催化剂能够有效降低反应的活化能并改变反应的焓变
C.反应①和总反应均为放热反应
D.增大压强和使用高效催化剂均有利于提高反应②③④的平衡转化率
难度: 中等查看答案及解析
-
设NA是阿伏加德罗常数的值,下列说法正确的是( )
A.11g基态硼原子含有的未成对电子数为3NA
B.1mol基态氟原子能量最高的能级上电子数为7NA
C.100mL1mol•L-l亚硫酸钠溶液含有的阴离子数目大于0.1NA
D.电解法精炼铜,阴极析出64gCu时,阳极转移的电子数大于2NA
难度: 中等查看答案及解析
-
下列实验方案不能达到相应目的的是( )
选项
目的
实验方案
A
比较AgCl、AgI的溶解度大小
向2mL、0.1mol•L-1AgNO3溶液滴加2滴0.1mol•L-1NaCl溶液,继续再滴加2滴0.1mol•L-lNaI溶液
B
研究酸碱性对化学平衡的影响
向两份5mL、0.1mol•L-1K2Cr2O7溶液中分别加入5滴3mol•L-1硫酸和5滴6mol•L-1的NaOH溶液
C
对比硫酸溶液、唾液对淀粉水解催化效果
同温时,分别向两份加有2滴碘水的淀粉稀溶液中加入1mL唾液和1mL稀硫酸
D
比较碳酸、醋酸和硼|酸的酸性强弱
分别向两份2mL等浓度的醋酸、硼酸溶液中加入1mL等浓度的NaHCO3溶液
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
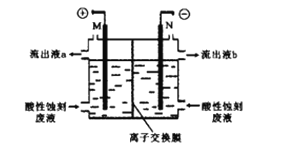
如图为Lil晶体锂电池的工作示意图,该电池具有使用寿命长、电压稳定等优点,常用于心脏起搏器的电源。下列说法错误的是( )
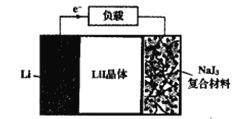
A.NaI3为电池的正极材料
B.电池工作时,Li+由NaI3移动到Li电极
C.正极电极反应为:2Li++NaI3+2e-=2LiI+NaI
D.该电池的总反应为:2Li+NaI3=2LiI+NaI
难度: 中等查看答案及解析
-
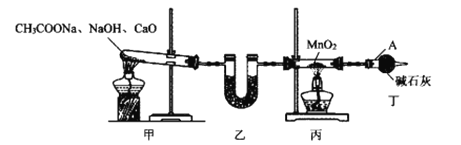
已知:焦性没食子酸的碱性溶液可吸收O2。碘化亚铁(FeI2)在常温下为灰黑色固体,易升华,可溶于水,具有潮解性。实验室用如图装置制备FeI2。下列说法错误的是( )
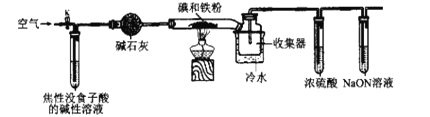
A.空气的主要作用是将产生的FeI2吹入收集器中
B.冷水的作用是将升华的FeI2凝华便于收集,使用粗玻璃管可以防止堵塞
C.浓硫酸的作用是防止水蒸气进入收集器而引起FeI2潮解
D.向FeI2溶液中通入等物质的量的Cl2,反应的离子方程式为:2Fe2++2Cl2=2Fe3++4Cl-
难度: 中等查看答案及解析
-
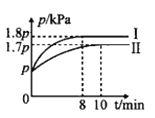
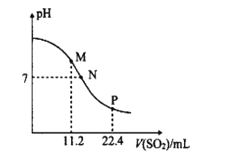
将2molX和0.8molY置于体积为2L的恒容密闭容器中,发生反应:2X(g)+Y(s)
M(g)+N(g) △H。反应过程中测得N的体积分数在不同温度下随时间的变化如图所示。下列说法正确的是( )
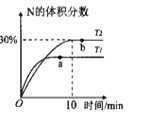
A.无论温度为T1还是T2,当容器中气体密度不变或压强不变时,反应达平衡状态
B.温度为T2时,X的平衡转化率为60%,平衡常数K=5.625
C.T1、T2的平衡常数分别为K1、K2,则K1<K2
D.降低温度、增大压强、及时分离出产物均有利于提高反应物的平衡转化率
难度: 中等查看答案及解析
-
某无色透明溶液X可能由K+、Cu2+、Ba2+、Al3+、CO32-、SO42-、AlO2-、SiO32-中的若干种离子组成。
①取适量该溶液,加入过量的稀硝酸,有气体生成,并得到无色溶液。
②在①所得溶液中加入过量的碳酸氢铵溶液,有气体生成,同时析出白色沉淀A。
③在②所得溶液中逐滴加入氢氧化钡溶液至过量,加热有气体生成并析出白色沉淀B。
下列说法正确的是( )
A.溶液中一定不含Cu2+、Ba2+、Al3+、CO32-、SO42-、SiO32-
B.溶液中一定含有K+、AlO2-、CO32-
C.溶液中可能含有SO42-、AlO2-
D.白色沉淀A一定为氢氧化铝,B一定为碳酸钡
难度: 中等查看答案及解析