-
下列说法正确的是( )
A.国庆70周年大典放飞的气球由可降解材料制成,主要成分是聚乙烯
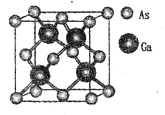
B.歼- 20上用到的氮化镓材料是一种金属合金材料
C.我国发射的“嫦娥三号”卫星所使用的碳纤维,是一种无机非金属材料
D.“绿水青山就是金山银山”。推广聚氯乙烯代替木材,生产快餐盒等,以减少术材的使用
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A.28g晶体硅中含有NA个Si-Si键
B.叠氮化铵(NH4N3)发生爆炸反应:NH4N3=2N2
+2H2
,当产生标准状况下22.4L气体时,转移电子的数目为NA
C.pH=1的H3PO4溶液中所含H+的数目为0.1NA
D.200mL1mol/LAl2(SO4)3溶液中A13+和SO42-的数目总和是NA
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.C2H6和C6H14一定互为同系物
B.甲苯分子中最多有13个原子共平面
C.石油裂解和油脂皂化均是由高分子物质生成小分子物质的过程
D.制乙烯时,配制乙醇和浓硫酸混合液:先加乙醇5mL,再加入浓硫酸15mL边加边振荡
难度: 中等查看答案及解析
-
下列依据实验操作及现象得出的结论正确的是( )
选项
实验操作
现象
结论
A
将待测液中,依次滴加氯水和KSCN溶液
溶液变为红色
待测溶液中含有Fe2+
B
向等体积等浓度的盐酸中分别加入ZnS和CuS
ZnS溶解而CuS不溶解
Ksp(CuS)< Ksp(ZnS)
C
向有少量铜粉的Cu(NO3)2溶液中滴入稀硫酸
铜粉逐渐溶解
稀硫酸能与铜单质反应
D
常温下,用pH计分别测0.1mol/LNaA溶液、0.1mol/LNa2CO3溶液的pH
NaA溶液的pH小于Na2CO3溶液的pH
酸性:HA>H2CO3
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
在K2Cr2O7存在下利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如下图。下列说法正确的是( )
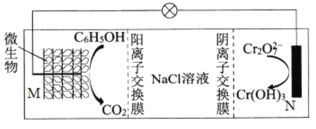
A.M为电源负极,有机物被还原
B.中间室水量增多,NaCl溶液浓度减小
C.M极电极反应式为:
+11H2O-23e-=6CO2+23H+
D.处理1molCr2O72-时有6mol H+从阳离子交换膜右侧向左侧迁移
难度: 困难查看答案及解析
-
X、Y、Z、W是四种原子序数依次增大的短周期元素,Z、W可以形成两种重要化合物ZW2、Z2W2,X、Y的原子半径依次减小,X、Y、Z组成的一种化合物(ZXY)2:的结构式为Y≡X-Z-Z-X≡Y。下列说法正确的是( )
A.化合物Z2W2中含有离子键
B.简单离子半径大小顺序:ry> rw> rz
C.元素W的氧化物对应水化物的酸性比Y的强
D.X和Z组成的化合物中可能所有原子都达到8电子稳定结构
难度: 困难查看答案及解析
-
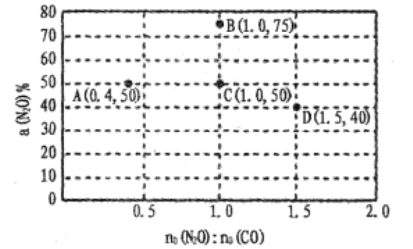
向某Na2CO3、NaHCO3的混合溶液中加入少量的BaCl2固体(溶液体积变化、温度变化忽略不计),测得溶液中离子浓度的关系如图所示,下列说法正确的是( )
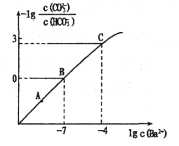
已知:Ksp(BaCO3)=2.40
10-9
A.A、B、C三点对应溶液pH的大小顺序为:A>B>C
B.A点对应的溶液中存在:c(CO32-)< c(HCO3-)
C.B点溶液中 c(CO32-)=0.24mol/L
D.向C点溶液中通入CO2可使C点溶液向B点溶液转化
难度: 困难查看答案及解析

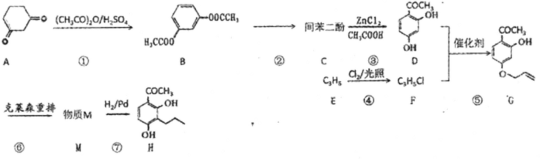
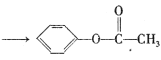 +CH3COOH
+CH3COOH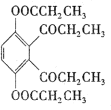 的合成路线(无机试剂任选)____。
的合成路线(无机试剂任选)____。