-
下列有关生活中的化学常识说法错误的是
A.肥沃的土壤保肥能力强的原因之一是土壤胶体粒子带电
B.粮食酿酒过程中会有 CO2 生成
C.泡沫灭火器的原理是利用 Al2(SO4)3 和Na2CO3溶液发生的双水解反应
D.红酒中含有的 SO2具有杀菌和抗氧化的作用
难度: 简单查看答案及解析
-
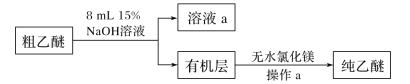
下图是制备乙酸乙酯的两种装置,下列说法错误的是

A.相比于 b,a装置具有副反应少、原料利用率高等优点
B.加入的浓硫酸要稍多于催化剂用量的原因是浓硫酸还起到吸水剂的作用,推动平衡正向进行
C.反应结束后,将收集到的产品倒入分液漏斗中,振荡、放气、静置、分液,然后从下口放出制备的产物
D.乙酸乙酯在饱和碳酸钠溶液中的溶解度较小
难度: 中等查看答案及解析
-
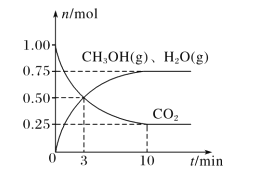
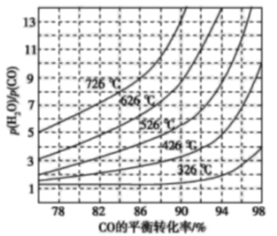
为研究某溶液中溶质 R的分解速率的影响因素,分别用三份不同初始浓度 R溶液在不同温度下进行实验,c(R)随时间变化如图。下列说法错误的是
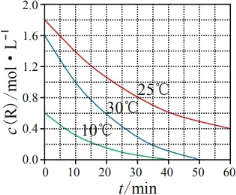
A.25℃时,10~30min 内,R 的分解平均速率为 0.030 mol·L-1·min-1
B.对比 30℃和 10℃曲线,在同一时刻,能说明 R的分解速率随温度升高而增大
C.对比 30℃和 25℃曲线,在 0~50min 内,能说明R 的分解平均速率随温度升高而增大
D.对比 30℃和 10℃曲线,在 50min 时,R 的分解率相等
难度: 困难查看答案及解析
-
5-羟色胺,最早是从血清中发现的,又名血清素。广泛存在于哺乳动物组织中,是一种抑制性神经递质。下列有关说法正确的是
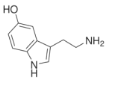
已知:五元氮杂环上的原子在同一平面上。
A.一定共平面的 C 原子有 9 个
B.苯环上的一氯代物有 2 种
C.分子中含有四种官能团,可发生加成、消去、中和等反应
D.5-羟色胺的分子式为 C10H10N2O
难度: 简单查看答案及解析
-
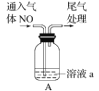
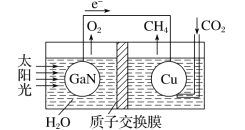
Fe3O4中含有Fe2+、Fe3+,分别表示为 Fe(Ⅱ)、Fe(Ⅲ),以Fe3O4/Pd为催化材料,可实现用 H2消除酸性废水中的致癌物 NO2-,其反应过程示意图如图所示,下列说法不正确的是
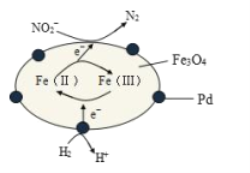
A.用该法处理后水体的 pH降低
B.Fe(Ⅱ)与 Fe(Ⅲ)的相互转化起到了传递电子的作用
C.反应过程中NO2-被 Fe(Ⅱ)还原为 N2
D.Pd 上发生的电极反应为:H2- 2e-== 2H+
难度: 中等查看答案及解析
-
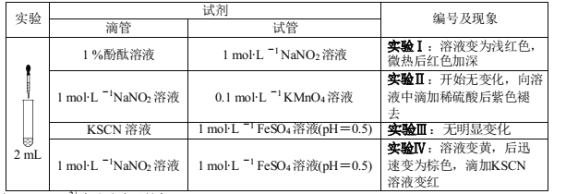
固体盐X由三种元素组成,可发生以下反应,下列说法不正确的是
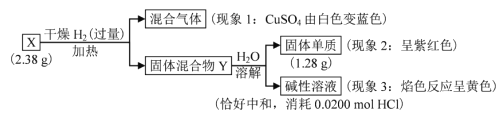
A.现象 1说明 X中含氧元素
B.固体混合物Y的成分是 Cu 和NaOH
C.X 与浓盐酸反应放出 Cl2 的反应为:2NaCuO2+8HCl == 2NaCl+2CuCl2+Cl2+4H2O
D.1molX与干燥 H2加热下的反应,转移电子数为 2NA
难度: 困难查看答案及解析
-
室温下,反应HCO3-+H2O
H2CO3+OH-的平衡常数为10-8 。将NH4HCO3溶液和氨水按一定比例混合,可用于浸取废渣中的ZnO。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是
A.0.2mol/L 氨水:c(NH3∙H2O)>c(NH4+)>c(OH-)>c(H+)
B.0.6 mol/L氨水和0.2 mol/L
溶液等体积混合:c(NH3∙H2O)+c(CO32-)+c(OH-)=0.3mol/L+2c(H2CO3)+c(H+)
C.0.2 mol/L氨水和0.2 mol/L
液等体积混合:c(NH4+)+c(NH3∙H2O)=c(H2CO3)+c(HCO3-)+c(CO32-)
D.0.2mol/L NH4HCO3溶液(pH>7):c(NH4+)>c(HCO3-)>c(H2CO3)>c(NH3∙H2O)
难度: 困难查看答案及解析

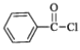 互为同分异构体的醛类化合物的结构简式(核磁共振氢谱为五组峰,峰面积比为1:1:1:1:1)_____;
互为同分异构体的醛类化合物的结构简式(核磁共振氢谱为五组峰,峰面积比为1:1:1:1:1)_____;