-
北宋杨亿、黄鉴《杨文公谈苑》中记载:“嘉州峨媚山有菩萨石,多人采之,色莹白,若泰山狼牙石、上饶水晶之类,日光射之有五色。”下列“石”与“菩萨石”具有相同的化学成分的是
A.硅石 B.冰晶石 C.石灰石 D.重晶石
难度: 简单查看答案及解析
-
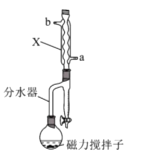
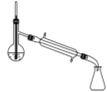
完成下列实验所需选择的装置或仪器都正确的是
A
B
C
D
实验
分离CCl4中的I2
除去水中的氯化钠
制取NO
称取NaOH固体
装置或仪器
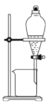
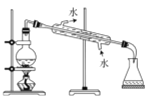
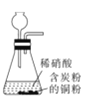
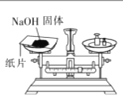
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
傅克反应是合成芳香族化合物的一种重要方法。有机物a(-R为烃基)和苯通过傳克反应合成b的过程如下(无机小分子产物略去)
下列说法错误的是
A.一定条件下苯与氢气反应的产物之一环己烯与螺[2.3]己烷
互为同分异构体
B.b的二氯代物超过三种
C.R为C5H11时,a的结构有3种
D.R为C4H9时,1molb加成生成C10H20至少需要3molH2
难度: 简单查看答案及解析
-
实验室利用SO2和Cl2在活性炭作用下制取SO2C12,原理为SO2(g)+Cl2(g)⇌SO2Cl2(l) ∆H=-97.3kJ/mol。装置如图所示(部分装置已省略)。已知SO2C12的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈反应并产生白雾。下列说法正确的是
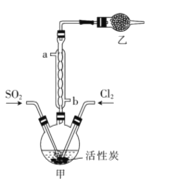
A.乙中盛放的试剂为无水氯化钙
B.制备过程中需要将装置甲置于冰水浴中
C.用来冷却的水应该从a口入,b口出
D.可用硝酸与亚硫酸钠反应制备二氧化硫
难度: 简单查看答案及解析
-
在乏燃料后处理流程中,四价铀作为铀钚分离的还原剂己广泛使用。在UO2(NO3)-2HNO3-N2H4。HNO3体系下采用电解法制备四价铀,电解总反应为2UO22++N2H5++3H+
2U4++N2↑+4H2O,电解装置如图所示。下列说法正确的是
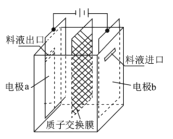
A.若转移4mol e-,将有4mol H+透过质子交换膜
B.b极的电极反应式为UO22++2H2O+2e-=U4++4OH-
C.电解液中NO3-的移动方向:a→质子交换膜→b
D.当产生11.2 mL N2时,同时生成U4+的质量为0.2389
难度: 中等查看答案及解析
-
短周期主族元素R、W、X、Y、Z的原子序数依次增大,R、Y同主族。m、n、q是由这些元素组成的三元化合物,0.1 mol∙L-l q溶液常温下的pH=1;r、s、t、u是由这些元素组成的二元化合物,r常用作调味剂,t通常为液态;v是元素X的一种常见单质。上述物质的转化关系如图所示。下列说法正确的是
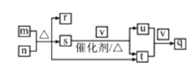
A.原子半径:R<W<X<Z<Y B.n、r、t中化学键类型相同
C.u、v、q中均含有X元素 D.m、s均属于碱
难度: 困难查看答案及解析
-
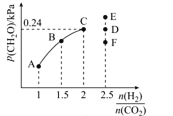
配离子的稳定性可用K不稳衡量,例如Ag(NH3)2]+的K不稳=
。在一定温度下,向0.1 mol/L硝酸银溶液中滴入稀氨水,发生反应Ag++2NH3⇌[Ag(NH3)2]+]。溶液中pNH3与δ(X)的关系如图。其中pNH3=-lg[c(NH3)]、δ(X)=
(X代表Ag+或Ag(NH3)2]+。下列说法不正确的是
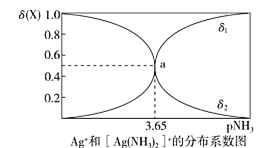
A.图中δ2代表的是δ([Ag(NH3)2]+]) B.向溶液中滴入稀硝酸,δ(Ag+)减小
C.该溶液中c(NH4+)+c(H+)=c(OH-) D.该温度时,K不稳([Ag(NH3)2]+)=10-7.3
难度: 困难查看答案及解析
 B.
B. 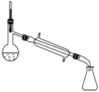 C.
C.  D.
D. 
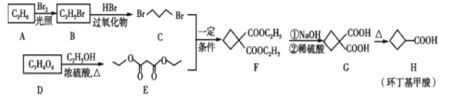
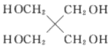 和
和 的路线________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
的路线________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)