-
著名化学家徐光宪在稀土化学等领域取得了卓越成就,被誉为“稀土界的袁隆平”。稀土元素包括钪、钇和镧系元素。请回答下列问题:
(1)写出基态二价钪离子(Sc2+)的核外电子排布式____,其中电子占据的轨道数为 ____。
(2)在用重量法测定镧系元素和使镧系元素分离时,总是使之先转换成草酸盐,然后经过灼烧而得其氧化物,如2LnCl3+3H2C2O4+nH2O=Ln2(C2O4)3∙nH2O+6HCl。
①H2C2O4中碳原子的杂化轨道类型为____;1 mol H2C2O4分子中含σ键和π键的数目之比为 ___。
②H2O的VSEPR模型为 ___;写出与H2O互为等电子体的一种阴离子的化学式_______。
③HCI和H2O可以形成相对稳定的水合氢离子盐晶体,如HCl∙2H2O,HCl∙2H2O中含有H5O2+,结构为 ,在该离子中,存在的作用力有___________
,在该离子中,存在的作用力有___________
a.配位键 b.极性键 c.非极性键 d.离子键 e.金属键 f氢键 g.范德华力 h.π键 i.σ键
(3)表中列出了核电荷数为21~25的元素的最高正化合价:
| 元素名称 | 钪 | 钛 | 钒 | 铬 | 锰 |
| 元素符号 | Sc | Ti | V | Cr | Mn |
| 核电荷数 | 21 | 22 | 23 | 24 | 25 |
| 最高正价 | +3 | +4 | +5 | +6 | +7 |
对比上述五种元素原子的核外电子排布与元素的最高正化合价,你发现的规律是___________
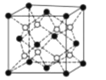
(4)PrO2(二氧化镨)的晶胞结构与CaF2相似,晶胞中Pr(镨)原子位于面心和顶点。假设相距最近的Pr原子与O原子之间的距离为a pm,则该晶体的密度为_____g∙cm-3(用NA表示阿伏加德罗常数的值,不必计算出结果)。
-
著名化学家徐光宪,因为在稀土萃取领域取得了卓越成就而获得“国家最高科学技术奖”,被誉为“稀土界的袁隆平”。稀土元素是指镧系的15种元素,加上钪和钇共17种元素。下列说法正确的是 ( )
A.稀土元素全部是金属元素
B.要萃取出碘酒中的碘可以使用氢氧化钠溶液做萃取剂
C.镧系元素均属于第七周期、第ⅢB族的元素
D.某些稀土元素在地壳中的含量高于铝
-
[s1] 著名化学家徐光宪,因为在稀土萃取领域取得了卓越成就而获得“国家最高科学技术奖”,被誉为“稀土界的袁隆平”。稀土元素是指镧系的15种元素,加上钪和钇共17种元素。下列说法正确的是 ( )
A.稀土元素全部是金属元素
B.要萃取出碘酒中的碘可以使用氢氧化钠溶液做萃取剂
 镧系元素均属于第七周期、第ⅢB族的元素
镧系元素均属于第七周期、第ⅢB族的元素
D.某些稀土元素在地壳中的含量高于铝
[s1]6.
-
著名化学家徐光宪,因为在稀土萃取领域取得的卓越成就被誉为“稀土界的袁隆平”;2009年,胡锦涛主席为其颁发了“国家最高科学技术奖”。稀土元素是指镧系的15种元素,加上钪和钇共17种元素。下列说法正确的是
A.镧系元素属于主族元素 B.要萃取出碘酒中的碘可用KOH溶液做萃取剂
C.稀土元素全部是金属元素 D.某些稀土元素在地壳中的含量高于铁
-
著名化学家徐光宪(画面正中),因为在稀土萃取领域取得的卓越成就被誉为“稀土界的袁隆平”;2008年1月9日,胡锦涛主席为其颁发了“国家最高科学技术奖”。稀土元素是指镧系的15种元素,加强钪和钇共17种元素。下列说法正确的是

A.稀土元素全部是金属元素
B.要萃取出碘酒中的碘可以使用氢氧化钠溶液做萃取剂
C.镧系元素均属于主族元素
D.某些稀土元素在地壳中的含量高于铝
-
著名化学家徐光宪(画面正中),因为在稀土萃取领域取得的卓越成就被誉为“稀土界的袁隆平”;2008年1月9日,胡锦涛主席为其颁发了“国家最高科学技术奖”.稀土元素是指镧系的15种元素,加上钪和钇共17种元素.下列说法正确的是( )

A.稀土元素全部是金属元素
B.要萃取出碘酒中的碘可以使用氢氧化钠溶液做萃取剂
C.镧系元素均属于主族元素
D.某些稀土元素在地壳中的含量高于铝
-
著名化学家徐光宪在稀土领域贡献突出,被誉为“稀土界的袁隆平”。钇是稀土元素之一,我国蕴藏着丰富的钇矿石 ,工业上通过如下工艺流程制取氧化钇,并获得副产物铍。
,工业上通过如下工艺流程制取氧化钇,并获得副产物铍。
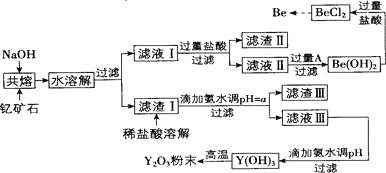
已知:
 钇
钇 的常见化合价为
的常见化合价为 价;
价;
 铍和铝处于元素周期表的对角线位置,化学性质相似;
铍和铝处于元素周期表的对角线位置,化学性质相似;
 、
、 形成氢氧化物沉淀时的pH如下表:
形成氢氧化物沉淀时的pH如下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2:1 | 3:1 |
| Y3+ | 6.0 | 8.3 |
 将钇矿石与NaOH共熔的反应方程式补充完整:
将钇矿石与NaOH共熔的反应方程式补充完整:
_____ _____
_____ _____
_____ _____
_____ _____
_____ _____
_____ _____
_____ _____
_____
 滤渣Ⅱ的主要成分是_________。
滤渣Ⅱ的主要成分是_________。
 试剂A可以是_________
试剂A可以是_________ 填序号
填序号 。
。
A NaOH溶液  氨水
氨水 

 用氨水调节
用氨水调节 时,a的取值范围是_____________。
时,a的取值范围是_____________。
 计算常温下
计算常温下 的平衡常数
的平衡常数 ____________。
____________。 常温下
常温下
 滤液Ⅲ加入氨水产生沉淀的离子方程式为___________。
滤液Ⅲ加入氨水产生沉淀的离子方程式为___________。
 从
从 溶液中得到
溶液中得到 固体的操作是_______。
固体的操作是_______。
-
著名化学家徐光宪在稀土领域贡献突出,被誉为“稀土界的袁隆平”。钇是稀土元素之一,我国蕴藏着丰富的钇矿石(Y2FeBe2Si2O10),工业上通过如下工艺流程制取氧化钇,并获得副产物铍。
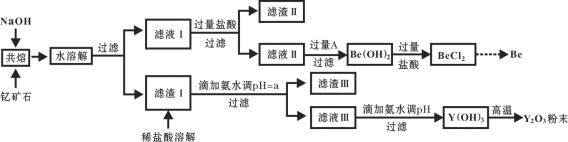
已知:ⅰ.钇(Y)的常见化合价为+3价;
ⅱ.铍和铝处于元素周期表的对角线位置,化学性质相似;
ⅲ.Fe3+、Y3+形成氢氧化物沉淀时的pH如下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.1 | 3.1 |
| Y3+ | 6.0 | 8.3 |
(1)将钇矿石与NaOH共熔的反应方程式补充完整:
__Y2FeBe2Si2O10+__NaOH+____  __Y(OH)3 +__Fe2O3 + __Na2SiO3 + __Na2BeO2 + __H2O
__Y(OH)3 +__Fe2O3 + __Na2SiO3 + __Na2BeO2 + __H2O
(2)滤渣Ⅱ的主要成分是____________。
(3)试剂A可以是___________。
A.NaOH溶液 B.氨水 C.CO2 D.CaO
(4)用氨水调节pH=a时,a的取值范围是_____________________。
(5)计算常温下Y3+ +3H2O Y(OH)3+3H+的平衡常数K=________。(常温下Ksp [Y(OH)3] = 8.0×10-23)
Y(OH)3+3H+的平衡常数K=________。(常温下Ksp [Y(OH)3] = 8.0×10-23)
(6)滤液Ⅲ加入氨水产生沉淀的离子方程式为_______________。
(7)从BeCl2溶液中得到BeCl2固体的操作是________。
(8)常见的由BeCl2固体生产Be的工业方法有两种:①电解法:电解NaCl-BeCl2混合熔融盐制备Be;②热还原法:熔融条件下,钾还原BeCl2制备Be。以上两种方法你认为哪种更好并请说明理由_________。
-
稀土元素(铈等金属)是重要的战略资源,在工业中有重要的应用,我国著名的化学家徐光宪因建立了稀土串级萃取理论,被誉为“中国稀土之父”。
(1)完成并配平下列反应的离子方程式:______Ce3+______H2O2+______H2O→______Ce(OH)4↓+____________。
(2)氧的原子核外共有______个电子亚层,H2O 的空间构型为______;
(3)若反应中有 52g Ce(OH)4 生成,则转移电子的数目为______;
(4)实验室中进行萃取实验时,除玻璃棒、烧杯之外,还需要的玻璃仪器名称______;
(5)取上述反应得到的 Ce(OH)4 样品 0.500g,加硫酸溶解后,用 0.100mol•L-1 FeSO4 标准溶液滴定至终点时(铈被还原为 Ce3+),消耗 20.00 mL 标准溶液。该样品中 Ce(OH)4的质量分数为______。
-
我国著名的化学家、教育家徐光宪先胜因在稀土金属等研究领域做出杰出贡献,荣获了2008年度“国家最高科学技术奖”。 是地壳中含量最高的稀土金属饰元素。下列关于
是地壳中含量最高的稀土金属饰元素。下列关于 的说法错误的是
的说法错误的是
A.质量数为140 B 中子数为82
C.质子数为58 D 核外电子数为198
,在该离子中,存在的作用力有___________




