-
减弱温室效应的方法之一是将CO2回收利用,科学家研究利用回收的CO2制取甲醛,反应的热化学方程式为CO2(g)+2H2(g)⇌CH2O(g)+H2O(g) ∆H。请回答下列问题:
(1)己知:
①CH2O(g)+O2(g)=CO2(g)+H2O(g) ∆H1=-480kJ/mol
②相关化学键的键能数据如表所示:
| 化学键 | O=O | H-H | O-H |
| 键能/kJ∙mol-1 | 498 | 436 | 464 |
则CO2(g)+2H2(g)⇌CH2O(g)+H2O(g) ∆H=____________
(2)一定条件下,将n(CO2):n(H2)=1:2的混合气体充入恒温恒容的密闭容器中,发生反应CO2(g)+2H2(g)⇌CH2O(g)+H2O(g)。
①下列说明反应已经达到平衡状态的是____(填选项字母)。
a.容器内气体密度保持不变 b.H2O的体积分数保持不变
c.该反应的平衡常数保持不变 d.混合气体的平均相对分子质量不变
②下列措施既能提高H2的转化率又能加快反应速率的是_____填选项字母)
a.升高温度 b.使用高效催化剂 c.缩小容器体积 d.扩大容器体积
(3)实验室在2L密闭容器中进行模拟上述合成CH2O的实验。T1℃时,将体积比为1:4的CO2和H2混合气体充入容器中,每隔一定时间测得容器内气体压强如表所示:
| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 压强/kPa | 1.08 | 0.96 | 0.88 | 0.82 | 0.80 | 0.80 | 0.80 |
①已知:vp(B)= 则反应开始10 min内,用H2的压强变化表示该反应的平均反应速率为 ___kPa∙min-1。
则反应开始10 min内,用H2的压强变化表示该反应的平均反应速率为 ___kPa∙min-1。
②T1℃时,反应的平衡常数Kp的代数式为Kp=_______kPa-1(Kp为用各气体分压表示的平衡常数,分压=总压×物质的量分数)。
(4)T2℃时,向体积为2L的恒容密闭容器中充入一定量的H2和CO2的混合气体,容器内气体压强为1.2 kPa,反应达到平衡时,CH2O的分压与起始的 关系如图所示:
关系如图所示:
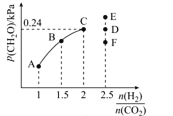
①当 =2时,反应达到平衡后,若再向容器中加入CO2(g)和H2O(g),使二者分压均增大0.05 kPa,则达到新平衡时,H2的转化率将_______(填“增大”“减小”或“不变”)。
=2时,反应达到平衡后,若再向容器中加入CO2(g)和H2O(g),使二者分压均增大0.05 kPa,则达到新平衡时,H2的转化率将_______(填“增大”“减小”或“不变”)。
②当 =2.5时,达到平衡状态后,CH2O的分压可能是图象中的点____(填“D”“E”或“F”),原因为_______
=2.5时,达到平衡状态后,CH2O的分压可能是图象中的点____(填“D”“E”或“F”),原因为_______
-
回收和利用CO2是环境科学家研究的热点,是减轻温室效应危害的重要途径。
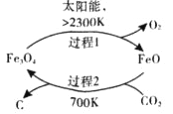
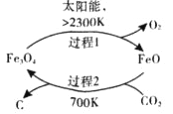
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图所示。其总反应的化学方程式为_____________。
(2)CO2经过催化氢化合成低碳烯烃。合成乙烯的反应为
2CO2(g)+6H2(g)==CH2=CH2(g)+4H2O(g) △H=akJ/mol
已知:
| 键 | H-H | C=O | C=C | O-H | C-H |
| 键能/kJ/mol | 436.0 | 745.0 | 615.0 | 462.8 | 413.4 |
则a=________。
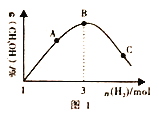
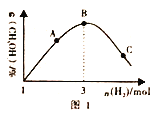
(3)T℃时。在恒容密闭容器中充入1molCO2和nmolH2,在一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<0,混合气体中CH3OH 的体积分数与氢气的物质的量的关系如图所示。图1中A、B、C 三点对应的体系。CO的转化率最大的是____(填字母),判断理由是____________。
CH3OH(g)+H2O(g) △H<0,混合气体中CH3OH 的体积分数与氢气的物质的量的关系如图所示。图1中A、B、C 三点对应的体系。CO的转化率最大的是____(填字母),判断理由是____________。

(4) 工业上也用合成气(H2和CO) 合成甲醇,反应为2H2(g)+CO(g) CH3OH(g) △H<0,在10L的恒容密团容器中充入H2和CO的物质的量分别为2mol和1mol,测得CO的平衡转化率与温度、压强的关系如图2所示。
CH3OH(g) △H<0,在10L的恒容密团容器中充入H2和CO的物质的量分别为2mol和1mol,测得CO的平衡转化率与温度、压强的关系如图2所示。
①图2中S代表的物理量是_________。
②已知300℃时上述反应达到平衡时,CO 的平衡转化率为60% 若再向该平衡体系中再加入2molCO、2molH2、2molCH3OH 若保持温度和容器休积不变,则平衡会_____(填“正向移动”“逆向移动”或“不移动”)。
(5)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下图所示:
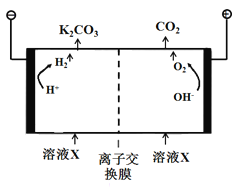
①阳极区产生CO2的原因是________(用离子方程式表示)。
②利用平衡移动原理,简述CO32-在阴极区再生的原因____________。
-
回收和利用CO2是环境科学家研究的热点,是减轻温室效应危害的重要途径。
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图所示。其总反应的化学方程式为_____________。
(2)CO2经过催化氢化合成低碳烯烃。合成乙烯的反应为
2CO2(g)+6H2(g)==CH2=CH2(g)+4H2O(g) △H=akJ/mol
已知:
| 键 | H-H | C=O | C=C | O-H | C-H |
| 键能/kJ/mol | 436.0 | 745.0 | 615.0 | 462.8 | 413.4 |
则a=________。
(3)T℃时。在恒容密闭容器中充入1molCO2和nmolH2,在一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<0,混合气体中CH3OH 的体积分数与氢气的物质的量的关系如图所示。图1中A、B、C 三点对应的体系。CO的转化率最大的是____(填字母),判断理由是____________。
CH3OH(g)+H2O(g) △H<0,混合气体中CH3OH 的体积分数与氢气的物质的量的关系如图所示。图1中A、B、C 三点对应的体系。CO的转化率最大的是____(填字母),判断理由是____________。

(4) 工业上也用合成气(H2和CO) 合成甲醇,反应为2H2(g)+CO(g) CH3OH(g) △H<0,在10L的恒容密团容器中充入H2和CO的物质的量分别为2mol和1mol,测得CO的平衡转化率与温度、压强的关系如图2所示。
CH3OH(g) △H<0,在10L的恒容密团容器中充入H2和CO的物质的量分别为2mol和1mol,测得CO的平衡转化率与温度、压强的关系如图2所示。
①图2中S代表的物理量是_________。
②已知300℃时上述反应达到平衡时,CO 的平衡转化率为60% 若再向该平衡体系中再加入2molCO、2molH2、2molCH3OH 若保持温度和容器休积不变,则平衡会_____(填“正向移动”“逆向移动”或“不移动”)。
(5)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下图所示:
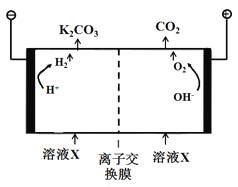
①阳极区产生CO2的原因是________(用离子方程式表示)。
②利用平衡移动原理,简述CO32-在阴极区再生的原因____________。
-
CO2是主要的温室气体,也是一种工业原料。回收利用CO2有利于缓解温室效应带来的环境问题。
(1)我国科学家通过采用一种新型复合催化剂,成功实现了CO2直接加氢制取高辛烷值汽油。
已知:2H2 (g)+O2 (g) =2H2O(l) ΔH = -571.6 kJ/mol
2C8H18(l)+25O2(g) =16CO2(g)+18H2O(l) ΔH = -11036 kJ/mol
25℃、101kPa条件下,CO2与H2反应生成辛烷(以C8H18表示)和液态水的热化学方程式是_________。
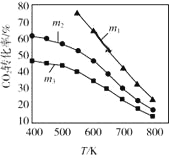
(2)CO2催化加氢合成乙醇的反应原理是:2CO2(g)+6H2(g) C2H5OH(g)+3H2O(g) △H =-173.6 kJ/mol图是起始投料不同时,CO2的平衡转化率随温度的变化关系,m为起始时的投料比,即m=
C2H5OH(g)+3H2O(g) △H =-173.6 kJ/mol图是起始投料不同时,CO2的平衡转化率随温度的变化关系,m为起始时的投料比,即m= 。m1、m2、m3投料比从大到小的顺序为_________,理由是_________。
。m1、m2、m3投料比从大到小的顺序为_________,理由是_________。
(3)在Cu/ZnO催化剂存在下,将CO2与H2混合可合成甲醇,同时发生以下两个平行反应:
反应Ⅰ CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH1=-53.7 kJ/mol
CH3OH(g)+H2O(g) ΔH1=-53.7 kJ/mol
反应Ⅱ CO2(g)+H2(g)  CO(g)+H2O(g) ΔH2=+41.2 kJ/mol
CO(g)+H2O(g) ΔH2=+41.2 kJ/mol
控制一定的CO2和H2初始投料比,在相同压强下,经过相同反应时间测得如下实验数据(其中“甲醇选择性”是指转化的CO2中生成甲醇的百分比):
| 实验序号 | T/K | 催化剂 | CO2转化率/% | 甲醇选择性/% |
| 实验1 | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
| 实验2 | 543 | Cu/ZnO纳米片 | 10.9 | 72.7 |
| 实验3 | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
| 实验4 | 553 | Cu/ZnO纳米片 | 12.0 | 71.6 |
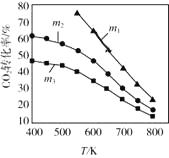
①对比实验1和实验3可发现:同样催化剂条件下,温度升高,CO2转化率升高, 而甲醇的选择性却降低,请解释甲醇选择性降低的可能原因_______________;
②对比实验1和实验 2可发现:在同样温度下,采用Cu/ZnO纳米片使CO2转化率降低, 而甲醇的选择性却提高,请解释甲醇的选择性提高的可能原因____________。
③有利于提高CO2转化为CH3OH平衡转化率的措施有_______。
a.使用Cu/ZnO纳米棒做催化剂
b.使用Cu/ZnO纳米片做催化剂
c.降低反应温度
d.投料比不变,增加反应物的浓度
e.增大 的初始投料比
的初始投料比
(4)以纳米二氧化钛膜为工作电极,稀硫酸为电解质溶液,在一定条件下通入CO2,电解,在阴极可制得低密度聚乙烯 (简称LDPE)。
(简称LDPE)。
①电解时,阴极的电极反应式是_____________。
②工业上生产1.4×104 kg 的LDPE,理论上需要标准状况下______L 的CO2。
-
CO2是主要的温室气体,也是一种工业原料。回收利用CO2有利于缓解温室效应带来的环境问题。
(1)我国科学家通过采用一种新型复合催化剂,成功实现了CO2直接加氢制取高辛烷值汽油。
已知:2H2 (g)+O2 (g) =2H2O(l) ΔH = -571.6 kJ/mol
2C8H18(l)+25O2(g) =16CO2(g)+18H2O(l) ΔH = -11036 kJ/mol
25℃、101kPa条件下,CO2与H2反应生成辛烷(以C8H18表示)和液态水的热化学方程式是_________。
(2)CO2催化加氢合成乙醇的反应原理是:2CO2(g)+6H2(g) C2H5OH(g)+3H2O(g) △H =-173.6 kJ/mol图是起始投料不同时,CO2的平衡转化率随温度的变化关系,m为起始时的投料比,即m=
C2H5OH(g)+3H2O(g) △H =-173.6 kJ/mol图是起始投料不同时,CO2的平衡转化率随温度的变化关系,m为起始时的投料比,即m= 。m1、m2、m3投料比从大到小的顺序为_________,理由是_________。
。m1、m2、m3投料比从大到小的顺序为_________,理由是_________。
(3)在Cu/ZnO催化剂存在下,将CO2与H2混合可合成甲醇,同时发生以下两个平行反应:
反应Ⅰ CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH1=-53.7 kJ/mol
CH3OH(g)+H2O(g) ΔH1=-53.7 kJ/mol
反应Ⅱ CO2(g)+H2(g)  CO(g)+H2O(g) ΔH2=+41.2 kJ/mol
CO(g)+H2O(g) ΔH2=+41.2 kJ/mol
控制一定的CO2和H2初始投料比,在相同压强下,经过相同反应时间测得如下实验数据(其中“甲醇选择性”是指转化的CO2中生成甲醇的百分比):
| 实验序号 | T/K | 催化剂 | CO2转化率/% | 甲醇选择性/% |
| 实验1 | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
| 实验2 | 543 | Cu/ZnO纳米片 | 10.9 | 72.7 |
| 实验3 | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
| 实验4 | 553 | Cu/ZnO纳米片 | 12.0 | 71.6 |
①对比实验1和实验3可发现:同样催化剂条件下,温度升高,CO2转化率升高, 而甲醇的选择性却降低,请解释甲醇选择性降低的可能原因_______________;
②对比实验1和实验 2可发现:在同样温度下,采用Cu/ZnO纳米片使CO2转化率降低, 而甲醇的选择性却提高,请解释甲醇的选择性提高的可能原因____________。
③有利于提高CO2转化为CH3OH平衡转化率的措施有_______。
a.使用Cu/ZnO纳米棒做催化剂
b.使用Cu/ZnO纳米片做催化剂
c.降低反应温度
d.投料比不变,增加反应物的浓度
e.增大 的初始投料比
的初始投料比
(4)以纳米二氧化钛膜为工作电极,稀硫酸为电解质溶液,在一定条件下通入CO2,电解,在阴极可制得低密度聚乙烯 (简称LDPE)。
(简称LDPE)。
①电解时,阴极的电极反应式是_____________。
②工业上生产1.4×104 kg 的LDPE,理论上需要标准状况下______L 的CO2。
-
过渡排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的资源.其中一种方案就是将CO2转化为可再生燃料甲醇(CH3OH).其化学方程式为:

请填空:
(1)写出上述反应的平衡常数表达式______:
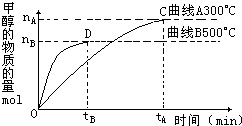
(2)在容积为2L的密闭容器中,用一定量的二氧化碳和一定量氢气在一定条件下合成甲醇,实验结果如图所示.下列说法正确的是______(填序号)
A.在300℃,从反应开始到平衡,甲醇的平均反应速率v(CH3OH)= mol•-1
mol•-1
B.反应体系从300℃升温到500℃,平衡常数K变化大
C.该反应的正反应为放热反应
D.处于C点的反应体系从300℃升高到500℃, 增大
增大
(3)25℃,1.01×105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出369.2kJ的热量,该反应的热化学方程式为:______.
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极应加入或通入的物质是______;正极的电极反应式:______.
-
二氧化碳的回收利用是环保领域研究热点。
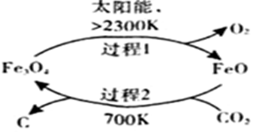
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如右图所示。总反应的化学方程式为 。
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2 CH3OH+H2O。已知298K和101KPa条件下:
CH3OH+H2O。已知298K和101KPa条件下:
CO2(g)+3H2(g) CH3OH(g)+H2O(l) △H=-a kJ·mol-1;
CH3OH(g)+H2O(l) △H=-a kJ·mol-1;
2H2(g)+O2(g)=2H2O(l) △H=-b kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-c kJ·mol-1,
则CH3OH(l)的标准燃烧热△H=___________________。
(3)CO2经过催化氢化合成低碳烯烃,合成乙烯反应为
2CO2 (g)+ 6H2(g) CH2= CH2(g) +4H2O(g) △H<0
CH2= CH2(g) +4H2O(g) △H<0
在恒容密闭容器中充入2 mol CO2和n mol H2,在一定条件下发生反应,CO2的转化率与温度、投料比 的关系如右图所示。
的关系如右图所示。
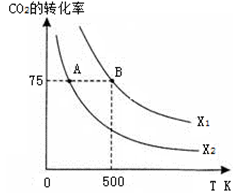
①平衡常数KA KB
②T K时,某密闭容器发生上述反应,反应进行到不同时间测得各物质的浓度如下:
| 时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| H2(g) | 6.00 | 5.40 | 5.10 | 9.00 | 8.40 | 8.40 |
| CO2(g) | 2.00 | 1.80 | 1.70 | 3.00 | 2.80 | 2.80 |
| CH2=CH2(g) | 0 | 0.10 | 0.15 | 3.20 | 3.30 | 3.30 |
20~30 min间只改变了某一条件,根据上表中的数据判断改变的条件可能是
A.通入一定量H2 B.通入一定量CH2=CH2
C.加入合适催化剂 D.缩小容器体积
画出CH2=CH2的浓度随反应时间的变化曲线。
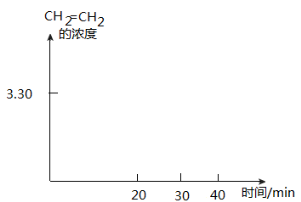
(4)在催化剂M的作用下,CO2和H2同时发生下列两个反应
A.2CO2 (g)+ 6H2(g) CH2= CH2(g) +4H2O(g) △H< 0
CH2= CH2(g) +4H2O(g) △H< 0
B.2CO2(g) + 6H2(g)  CH3OCH3(g)+3H2O(g) △H< 0
CH3OCH3(g)+3H2O(g) △H< 0

上图是乙烯在相同时间内,不同温度下的产率,则高于460℃时乙烯产率降低的原因不可能是
A.催化剂M的活性降低 B.A反应的平衡常数变大
C.生成甲醚的量增加 D.B反应的活化能增大
(5)Na2CO3溶液也通常用来捕获CO2。常温下,H2CO3的第一步、第二步电离常数分别约为Ka1=4×10-7 ,Ka2=5×10-11,则0.5mol·L-1的Na2CO3溶液的pH等于 (不考虑第二步水解和H2O的电离)
-
二氧化碳是常见的温室气体,其回收利用是环保领域研究的热点课题。
Ⅰ.CO2可以与H2反应合成C2H4,该转化分两步进行:
第一步:CO2(g)+H2(g) CO(g)+H2O(g) △H=+41.3kJ·mol-1
CO(g)+H2O(g) △H=+41.3kJ·mol-1
第二步:2CO(g)+4H2(g) C2H4(g)+2H2O(g) △H=–210.5kJ·mol-1
C2H4(g)+2H2O(g) △H=–210.5kJ·mol-1
(1)CO2与H2反应反应合成乙烯的热化学方程式为___。
(2)一定条件下的密闭容器中,要提高CO2合成乙烯的转化率,可以采取的措施是____(填标号)。
①减小压强 ②增大H2的浓度 ③加入适当催化剂 ④分离出H2O(g)
(3)己知温度对CO2合成乙烯的平衡转化率及催化剂的催化效率的影响如图所示,下列说法正确的是____(填标号)。
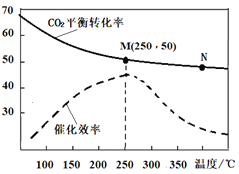
①N点的速率最大
②M点的平衡常数比N点的平衡常数大
③温度低于250℃时,随温度升高乙烯的平衡产率增大
④实际反应尽可能在较低的温度下进行,以提高CO2的转化率
Ⅱ.研究表明CO2和H2在一定条件下可以合成甲醇,反应方程式为CO2(g)+3H2(g) CH3OH(g)+H2O(g)[反应①]。一定条件下,往2L恒容密闭容器中充入2.0mo1CO2和4.0molH2,在不同催化剂作用下合成甲醇,相同时间内CO2的转化率随温度变化如图所示:
CH3OH(g)+H2O(g)[反应①]。一定条件下,往2L恒容密闭容器中充入2.0mo1CO2和4.0molH2,在不同催化剂作用下合成甲醇,相同时间内CO2的转化率随温度变化如图所示:
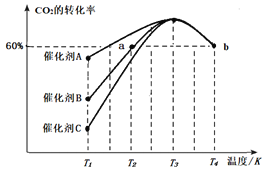
(4)催化效果最佳的是催化剂____(填“A”、“B”或“C”)。
(5)T2温度下,若反应进行10min达到图中a点状态,用CO2的浓度表示的反应速率v(CO2)=____。
(6)图中b点已达平衡状态,则该温度下反应的平衡常数K=____。
(7)在某催化剂作用下,CO2和H2除发生反应①外,还发生如下反应:CO2(g)+H2(g) CO(g)+H2O(g)[反应②]。维持压强不变,按固定初始投料比将CO2和H2按一定流速通过该催化剂,经过相同时间测得如下实验数据:
CO(g)+H2O(g)[反应②]。维持压强不变,按固定初始投料比将CO2和H2按一定流速通过该催化剂,经过相同时间测得如下实验数据:
| T(K) | CO2实际转化率(%) | 甲醇选择性(%) |
| 543 | 12.3 | 42.3 |
| 553 | 15.3 | 39.1 |
注:甲醇的选择性是指发生反应的CO2中转化为甲醇的百分比。表中数据说明,升高温度CO2的实际转化率提高而甲醇的选择性降低,其原因是____。
-
CO2的回收利用对减少温室气体排放、改善人类生存环境具有重要意义。利用CO2和CH4重整可制合成气(主要成分CO、H2).重整过程中部分反应的热化学方程式为:
①CH4(g)=C(s)+2H2(g) △H=+75.0 kJ/mol
②CO2(g)+H2(g)=CO(g)+H2O(g) △H=+41.0 kJ/mol
③CO(g)+H2(g)=C(s)+H2O(g) △H=-131.0kJ/mol
(1)反应CO2(g)+CH4(g)=2CO(g) + 2H2(g)的△H=____________;
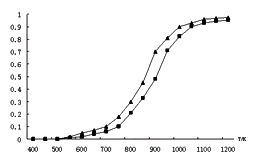
(2)固定n(CO2)= n(CH4),改变反应温度,CO2和CH4的平衡转化率见下左图。
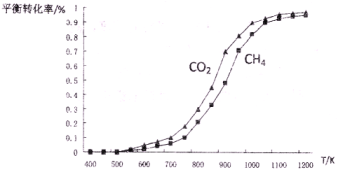
①同温度下CO2的平衡转化率____________(填“大于”或“小于”)CH4的平衡转化率,其原因是____________;
②高温下进行该反应时常会因反应①生成“积碳”(碳单质),造成催化剂中毒,高温下反应①能自发进行的原因是____________。
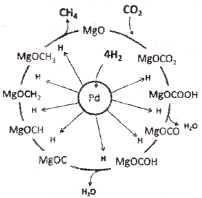
(3)一定条件下Pd-Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如上右图所示,该反应的化学方程式为____________,反应过程中碳元素的化合价为-2价的中间体是____________。
(4)卤水可在吸收烟道气中CO2的同时被净化,实现以废治废,其中涉及的一个反应是CaSO4 + Na2CO3=CaCO3 + Na2SO4,则达到平衡后,溶液中c(CO32-)/c(SO42-)=____________[用Ksp(CaSO4)和Ksp(CaCO3)表示]
-
CO2的回收利用对减少温室气体排放、改善人类生存环境具有重要意义。利用CO2和CH4重整可制合成气(主要成分CO、H2),重整过程中部分反应的热化学方程式为: ①CH4(g) = C(s) + 2H2(g) △H = +75.0 kJ·mol-1
②CO2(g) + H2(g) = CO(g) + H2O(g) △H = +41.0 kJ·mol-1
③CO(g) + H2(g) = C(s) + H2O(g) △H = -131.0 kJ·mol-1
(1)反应CO2(g) + CH4(g) = 2CO(g) + 2H2(g)的△H= ___________。
(2)固定n(CO2)= n(CH4),改变反应温度,CO2和CH4的平衡转化率见下图。
①同温度下CO2的平衡转化率 ____________(填“大于”或“小于”)于CH4的平衡转化率,其原因是 __________________________。
②高温下进行该反应时常会因反应①生成“积碳”(碳单质),造成催化剂中毒,高温下反应①能自发进行的原因是_________________。
(3)一定条件下Pd-Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如图所示,该反应的化学方程式为_____________________,反应过程中碳元素的化合价为-2价的中间体是__________。

(4)卤水可在吸收烟道气中CO2的同时被净化,实现以废治废,其中涉及的一个反应是CaSO4 + Na2CO3 == CaCO3 + Na2SO4,则达到平衡后,溶液中c(CO32-)/c(SO42-) = __________。【用Ksp(CaSO4)和Ksp(CaCO3)表示】
则反应开始10 min内,用H2的压强变化表示该反应的平均反应速率为 ___kPa∙min-1。
关系如图所示:

=2时,反应达到平衡后,若再向容器中加入CO2(g)和H2O(g),使二者分压均增大0.05 kPa,则达到新平衡时,H2的转化率将_______(填“增大”“减小”或“不变”)。
=2.5时,达到平衡状态后,CH2O的分压可能是图象中的点____(填“D”“E”或“F”),原因为_______




















