-
2019年12月以来,我国部分地区突发的新型冠状病毒肺炎威胁着人们的身体健康。以下是人们在面对新型冠状病毒肺炎时的一些认识,其中正确的是( )
A.新型冠状病毒由C、H、O三种元素组成
B.防护服、口罩的制备均要用到有机高分子材料
C.过氧化氢、乙醇、过氧乙酸等消毒液均可以将病毒氧化而达到消毒的目的
D.84消毒液是以NaClO为主要有效成分的消毒液,为了提升消毒效果,可以用热水配制
难度: 简单查看答案及解析
-
三位分别来自法国、美国、荷兰的科学家因研究“分子机器的设计与合成”而获得2016年诺贝尔化学奖。纳米分子机器日益受到关注,机器的“车轮”常用组件如图。下列说法不正确的是( )
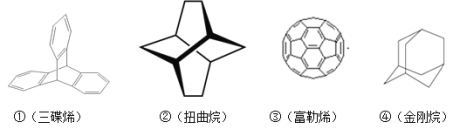
A.①③均能发生加成反应
B.②④互为同分异构体
C.①②③④均属于烃
D.①②④的一氯代物分别为3种、3种、2种
难度: 中等查看答案及解析
-
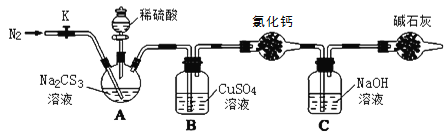
实验室石蜡催化裂化的装置如图所示,关于实验操作或叙述错误的是( )
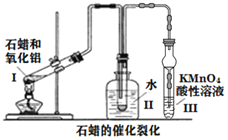
A.试管Ⅰ连的玻璃导管加长是为使气态石蜡冷凝回流
B.装置Ⅱ中冷水的作用是冷凝收集裂化油
C.试管Ⅲ中溶液颜色变浅甚至褪色可说明有乙烯生成
D.酸性KMnO4溶液若倒吸可加快褪色速率
难度: 中等查看答案及解析
-
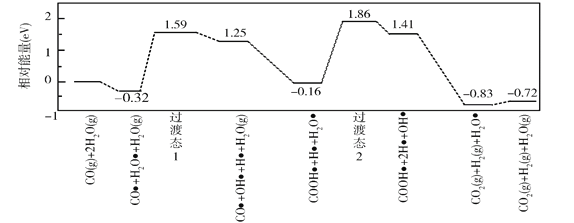
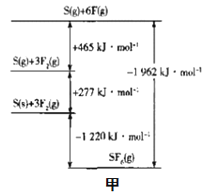
最近,中国科学院大连物化所CO2催化转化为CO的研究获得新成果。如图是使用不同催化剂(NiPc和CoPc)时转化过程中的能量变化。下列说法不合理的是( )
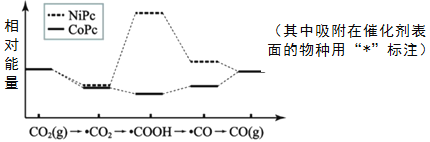
A.转化过程中有极性键形成
B.*CO2经氧化反应得到*COOH
C.吸附在NiPc和CoPc表面带有相同基团的物种其能量不同
D.该研究成果有利于缓解温室效应并解决能源转化问题
难度: 中等查看答案及解析
-
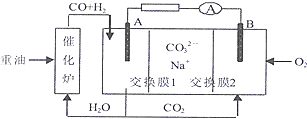
常温常压下电解法合成氨的原理如图所示。下列说法中错误的是( )
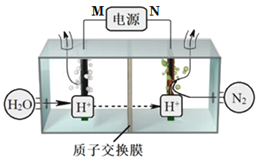
A.M为外接电源的正极
B.右室电极反应式为N2+6H++6e-=2NH3
C.理论上左、右室产生的气体同温同压下体积比为3︰4
D.该合成氨反应是化合反应、放热反应
难度: 中等查看答案及解析
-
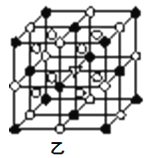
分属周期表前三周期的四种元素W、X、Y、Z可形成结构如图的物质,该物质中所有原子均满足稳定结构,W的原子序数最大,Y、Z处于同一周期。下列说法错误的是( )
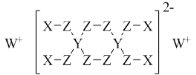
A.在该物质中,Y的化合价为+4价
B.X和Z可以形成具有强氧化性的化合物
C.由Z和W形成的化合物中可以存在共价键
D.X、Y、Z的原子半径从大到小为Y>Z>X
难度: 中等查看答案及解析
-
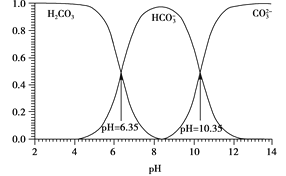
已知:MOH碱性比NOH强。常温下,用HCl气体分别改变浓度均为0.1mol·L-1的MOH溶液和NOH溶液的pH(溶液体积变化忽略不计),溶液中M+、N+的物质的量浓度负对数与溶液的pH关系如下图,pR=-lgc(M+)或-lgc(N+),下列说法错误的是( )
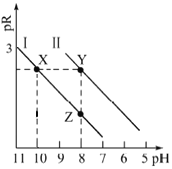
A.曲线I表示-lgc(M+)与pH关系
B.常温下,电离常数
=100
C.溶液中水的电离程度:Y>X
D.对应溶液中c(Cl-):Y>Z
难度: 困难查看答案及解析
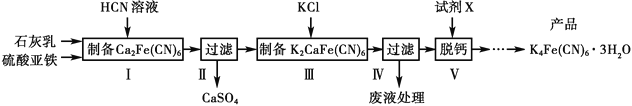

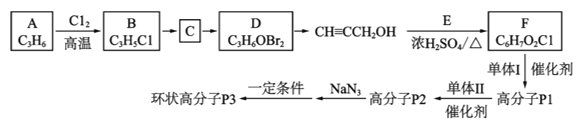
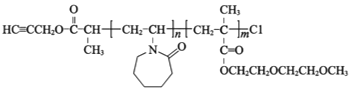
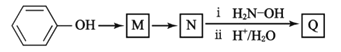
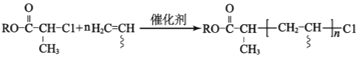 (
(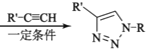
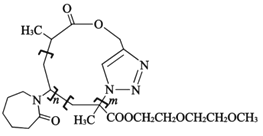
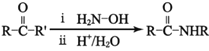 ;Q(C6H11NO)是用于合成单体I的中间体。如图是以苯酚为原料合成Q的流程,M→N的化学方程式是__。
;Q(C6H11NO)是用于合成单体I的中间体。如图是以苯酚为原料合成Q的流程,M→N的化学方程式是__。