-
氟及其化合物用途十分广泛,回答下列问题:
(1)氟化物OF2、NF3、SiF4、PF5、SF6中,中心原子采取sp3杂化的是__。
(2)[H2F]+[SbF6]-(氟锑酸)是一种超强酸。锑的价电子排布式为__。阳离子[H2F]+的空间构型为__,写出[H2F]+的等电子体__(分子和离子各举一例)。
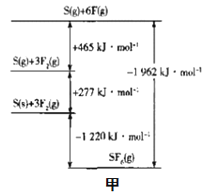
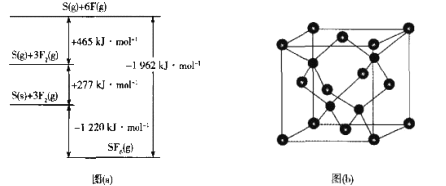
(3)SF6被广泛用于高压电器设备的绝缘介质。根据__理论,可判断出其空间构型为正八面体。SF6的键能可通过类似Born-Haber循环能量构建能量图(图甲)计算键能,则S-F的键能为___kJ•mol-1。
(4)工业上电解Al2O3制取单质铝,常利用冰晶石Na3[AlF6]降低Al2O3的熔点。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2Na3[AlF6]+3CO2↑+9H2O。
①测定气态HF的摩尔质量时,往往得不到20g•mol-1的数据,原因是__。
②冰晶石的晶体不导电,但熔融时能导电,则在冰晶石晶体中存在__(填序号)。
a.离子键 b.极性键 c.配位键 d.范德华力
③反应物中元素(氢除外)的第一电离能从大到小的顺序为__(用元素符号表示)。
④工业上不用电解熔点更低的AlCl3制取铝的原因为__。
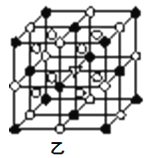
⑤冰晶石由两种微粒构成,冰晶石的晶胞结构如图乙所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是__(填具体的微粒符号)。
-
I下列描述中正确的是______
A、CS2为V形的极性分子
B、Cl03- 的空间构型为平面三角形
C、SF6中有6对完全相同的成键电子对
D、SiF4和SO32- 的中心原子均为sp3杂化
Ⅱ金属镍及其化合物在合金材料以及催化剂等方面应用广泛.请回答下列问题:
(1)Ni原子的核外电子排布式为______;
(2)Ni0、Fe0的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO______ FeO(填“<”或“>”);
(3)Ni0晶胞中Ni和O的配位数分别为______、______;
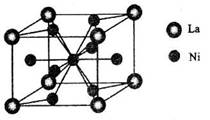
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示.该合金的化学式为______;
(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图所示.
①该结构中,碳碳之间的共价键类型是σ键,碳氮之间的共价键类型是______,氮镍之间形成的化学键是______;
②该结构中,氧氢之间除共价键外还可存在______;
③该结构中,碳原子的杂化轨道类型有______.
-
下列描述中正确的是 ( )
A.CS2为V形的极性分子
B.ClO3—的空间构型为平面三角形
C.SF6中有6对完全相同的成键电子对
D.SiF4的中心原子为sp3杂化,SO32—的中心原子为sp2杂化
-
19-I(6分)下列描述中正确的是
A.CS2为V形的极性分子
B.Cl0— 3 的空间构型为平面三角形
C.SF6中有6对完全相同的成键电子对
D.SiF4和SO2— 3 的中心原子均为sp3杂化
19-Ⅱ(14分)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为______________________________;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO ________ FeO(填“<”或“>”);
(3)NiO晶胞中Ni和O的配位数分别为_______________._______________;
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为_______________;
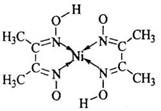
(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如右上图所示。
①该结构中,碳碳之间的共价键类型是 键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________;
键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________;
②该结构中,氧氢之间除共价键外还可存在_______________;
③该结构中,碳原子的杂化轨道类型有_______________。
-
19-I(6分)下列描述中正确的是
A、CS2为V形的极性分子
B、Cl0— 3 的空间构型为平面三角形
C、SF6中有6对完全相同的成键电子对
D、SiF4和SO2— 3 的中心原子均为sp3杂化
19-Ⅱ(14分)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为______________________________;
(2)Ni0、Fe0的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO ________ FeO(填“<”或“>”);
(3)Ni0晶胞中Ni和O的配位数分别为_______________、_______________;
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为_______________;
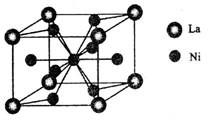

(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如右上图所示。
①该结构中,碳碳之间的共价键类型是 键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________;
键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________;
②该结构中,氧氢之间除共价键外还可存在_______________;
③该结构中,碳原子的杂化轨道类型有_______________。
-
(20分)
19-I(6分)下列描述中正确的是
A、CS2为V形的极性分子
B、Cl0— 3 的空间构型为平面三角形
C、SF6中有6对完全相同的成键电子对
D、SiF4和SO2— 3 的中心原子均为sp3杂化
19-Ⅱ(14分)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为______________________________;
(2)Ni0、Fe0的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO ________ FeO(填“<”或“>”);
(3)Ni0晶胞中Ni和O的配位数分别为_______________、_______________;
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为_______________;
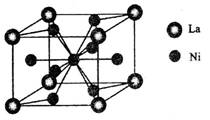
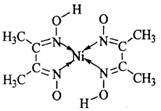
(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如右上图所示。
①该结构中,碳碳之间的共价键类型是 键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________;
键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________;
②该结构中,氧氢之间除共价键外还可存在_______________;
③该结构中,碳原子的杂化轨道类型有_______________。
-
铜及其化合物在工农业生产和日常生活中有着广泛的用途。请回答下列问题:
(1)基态铜原子的核外电子排布式为___。
(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2 NF3+3NH4F
NF3+3NH4F
①上述化学方程式中的5种物质所属的晶体类型有__ 填序号
填序号 。
。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
②F、N、O三种元素的第一电离能由大到小的顺序为__ 用元素符号表示
用元素符号表示
(3)铜晶体铜原子的堆积方式为面心立方最密堆积。每个铜原子周围距离最近的铜原子数目为___。
(4)某X原子的外围电子排布式为3s23p5,铜与X形成化合物的晶胞如图所示(黑点代表铜原子)。
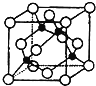
 该晶体的化学式为___。
该晶体的化学式为___。
②已知该晶体的密度为ρg·cm-3,阿伏加德罗常数的数值为NA,则该晶体中晶胞的棱长为__pm(只写计算式 。
。
(5)合成氨工艺的一个重要工序是铜洗,其目的是用铜液 醋酸二氨合铜(I)、氨水
醋酸二氨合铜(I)、氨水 吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:Cu(NH3)2Ac+CO+NH3⇌[Cu(NH3)3CO]Ac(Ac表示醋酸根
吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:Cu(NH3)2Ac+CO+NH3⇌[Cu(NH3)3CO]Ac(Ac表示醋酸根
①如果要提高上述反应的反应速率,可以采取的措施是___。(选填编号)
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
②铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为___。
③NH3的氮原子的杂化类型为___。
-
铜及其化合物在工农业生产和日常生活中有着广泛的用途。请回答下列问题:
(1)基态铜原子的核外电子排布式为___。
(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2 NF3+3NH4F
NF3+3NH4F
①上述化学方程式中的5种物质所属的晶体类型有__ 填序号
填序号 。
。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
②F、N、O三种元素的第一电离能由大到小的顺序为__ 用元素符号表示
用元素符号表示
(3)铜晶体铜原子的堆积方式为面心立方最密堆积。每个铜原子周围距离最近的铜原子数目为___。
(4)某X原子的外围电子排布式为3s23p5,铜与X形成化合物的晶胞如图所示(黑点代表铜原子)。

 该晶体的化学式为___。
该晶体的化学式为___。
②已知该晶体的密度为ρg·cm-3,阿伏加德罗常数的数值为NA,则该晶体中晶胞的棱长为__pm(只写计算式 。
。
(5)合成氨工艺的一个重要工序是铜洗,其目的是用铜液 醋酸二氨合铜(I)、氨水
醋酸二氨合铜(I)、氨水 吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:Cu(NH3)2Ac+CO+NH3⇌[Cu(NH3)3CO]Ac(Ac表示醋酸根
吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:Cu(NH3)2Ac+CO+NH3⇌[Cu(NH3)3CO]Ac(Ac表示醋酸根
①如果要提高上述反应的反应速率,可以采取的措施是___。(选填编号)
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
②铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为___。
③NH3的氮原子的杂化类型为___。
-
氟及其化合物用途十分广泛,回答下列问题
(1)聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序的独特晶体,可通过_____方法区分晶体、准晶体和非晶体。
(2)基态铜原子价电子排布的轨道式为_____。
(3)[H2F] + [SbF6] -(氟锑酸)是一种超强酸,其阳离子的空间构型为_____,与[H2F] +具有相同空间构型和键合形式的分子和阴离子分别是 ____。(各举一例)
(4)SF6中含____个σ键,根据____ 理论,可判断出其空间构型为正八面体,其中S的杂化方式为_____。
(5)SF6被广泛用于高压电器设备的绝缘介质。其键能可通过类似于Born-Haber循环能量构建能量图a计算键能。则F-F键的键能为_____kJ·mol-1 。
(6)CuCl 熔点为 426℃,熔化时几乎不导电;CuF 的熔点是 908℃,密度为 7.1g·cm-3 。
①CuF的熔点比CuCl高的原因是_____。
②已知NA为阿伏伽德罗常数的值,立方CuF晶胞结构如图b,则CuF的晶胞参数a= ____nm。(列出计算式即可)
-
氮的化合物在工农业生产及航天航空中具有广泛的用途。请回答下列问题:
(1)NF3为无色、无味的气体,可用于微电子工业,该物质在潮湿的环境中易变质生成HF、NO、HNO3。该反应中氧化剂与还原剂的物质的量之比为_____,NF3在空气中泄漏时很容易被观察到,原因是____________________________。
(2)雾霾成分中含有氮的氧化物(NOx),在合适催化剂的作用下,用CH4可对雾霾中的氮的氧化物进行无害化处理。已知下列两个热化学方程式:
①CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(g) △H 1=-574 kJ·mol-1
②CH4(g) +2NO2(g)==N2(g)+ CO2(g)+2H2O(g) △H 2=-867 kJ·mol-1
则用CH4还原NO生成N2的热化学方程式为_________________________。
(3)一定温度下,在AgNO3溶液中滴加连二次硝酸钠(Na2N2O2)溶液,可得到Ag2N2O2黄色沉淀,向该分散系中滴加Na2SO4溶液,当白色沉淀和黄色沉淀共存时,此时分散系中的 =___。[已知Ksp(Ag2SO4)=l.2×10-5,Ksp(Ag2N2O2)=4.0×10-9]
=___。[已知Ksp(Ag2SO4)=l.2×10-5,Ksp(Ag2N2O2)=4.0×10-9]
(4)已知某温度下:
N2O2(g)==2NO2(g) △H=+57 kJ·mol-1
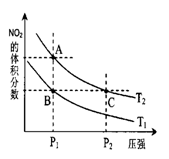
当温度为T1℃、T2℃时,平衡体系中NO2的体积分数与压强的变化曲线如图所示,则T1____(填“>”“<”或“=”)T2,体系中颜色最深的点是____(填“A”“B”或“C”)。
②在100℃时,容积为5L的真空密闭容器中加入—定量的N2O4,容器内N2O4和NO2的物质的量变化如下表所示:
| 时间/s | 0 | 2 | 10 | 30 | 60 | 90 |
| n(N2O4)/mol | 0.3 | 0.25 | 0.15 | 0.125 | b | 0.12 |
| n(NO2)/mol | 0 | 0.1 | a | 0.35 | 0.36 | 0.36 |
前10s,以NO2浓度变化表示的平均反应速率v(NO2)=____ mol·L-1·s-1,该温度下的平衡常数K=____。体系已达平衡,此时容器内压强为反应前的___倍。