-
氮的化合物在工农业生产及航天航空中具有广泛的用途。请回答下列问题:
(1)NF3为无色、无味的气体,可用于微电子工业,该物质在潮湿的环境中易变质生成HF、NO、HNO3。该反应中氧化剂与还原剂的物质的量之比为_____,NF3在空气中泄漏时很容易被观察到,原因是____________________________。
(2)雾霾成分中含有氮的氧化物(NOx),在合适催化剂的作用下,用CH4可对雾霾中的氮的氧化物进行无害化处理。已知下列两个热化学方程式:
①CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(g) △H 1=-574 kJ·mol-1
②CH4(g) +2NO2(g)==N2(g)+ CO2(g)+2H2O(g) △H 2=-867 kJ·mol-1
则用CH4还原NO生成N2的热化学方程式为_________________________。
(3)一定温度下,在AgNO3溶液中滴加连二次硝酸钠(Na2N2O2)溶液,可得到Ag2N2O2黄色沉淀,向该分散系中滴加Na2SO4溶液,当白色沉淀和黄色沉淀共存时,此时分散系中的 =___。[已知Ksp(Ag2SO4)=l.2×10-5,Ksp(Ag2N2O2)=4.0×10-9]
=___。[已知Ksp(Ag2SO4)=l.2×10-5,Ksp(Ag2N2O2)=4.0×10-9]
(4)已知某温度下:
N2O2(g)==2NO2(g) △H=+57 kJ·mol-1
当温度为T1℃、T2℃时,平衡体系中NO2的体积分数与压强的变化曲线如图所示,则T1____(填“>”“<”或“=”)T2,体系中颜色最深的点是____(填“A”“B”或“C”)。
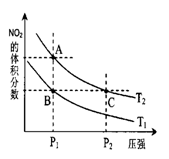
②在100℃时,容积为5L的真空密闭容器中加入—定量的N2O4,容器内N2O4和NO2的物质的量变化如下表所示:
| 时间/s | 0 | 2 | 10 | 30 | 60 | 90 |
| n(N2O4)/mol | 0.3 | 0.25 | 0.15 | 0.125 | b | 0.12 |
| n(NO2)/mol | 0 | 0.1 | a | 0.35 | 0.36 | 0.36 |
前10s,以NO2浓度变化表示的平均反应速率v(NO2)=____ mol·L-1·s-1,该温度下的平衡常数K=____。体系已达平衡,此时容器内压强为反应前的___倍。
-
氮的化合物在工农业生产及航天航空业中具有广泛的用途。回答下列问题:
⑴NF3为无色、无味的气体,可用于微电子工业,该物质在潮湿的环境中易变质生成HF、NO、HNO3。该反应中氧化剂与还原剂的物质的量之比为______,NF3在空气中泄漏时很容易被观察到,原因是_______。
⑵汽车尾气中催化剂可将NO、CO转化成无害气体。
| 化学键 | C≡O | NO中氮氧键 | N≡N | CO2中C=O键 |
| 键能/kJ·mol1 | 1076 | 630 | 945 | 803 |
2NO(g)+2CO(g)⇌N2(g)+2CO2(g) ΔH
①ΔH=______________________________kJ·mol1。
②该反应的平衡常数与外界因素X(代表温度、压强、 或催化剂接触面)关系如下图所示。
或催化剂接触面)关系如下图所示。
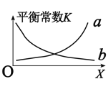
X是______,能正确表达平衡常数K随X变化的曲线是_______(填:a或b)。
⑶在一定温度和催化剂作用下,8NH3(g)+8NO(g)+2NO2(g)⇌9N2(g)+12H2O(g)在2L密闭容器中通入4molNH3、4molNO、nmolNO2,经10分钟时达到平衡时,c(NH3)=0.5mol·L1,c(NO2)=0.25mol·L1。
①n=_____;
②υ(NO)=______;
③NH3的平衡转化率为_________。
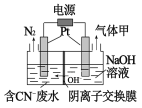
⑷用电解法将某工业废水中CN-转变为N2,装置如下图所示。电解过程中,阴极区电解质溶液的pH将____________(填:增大、减小或不变)。阳极的电极反应式为______________。
-
NF3(三氟化氮)在常温常压下是无色、无味的气体,是微电子工业中一种优良的等离子蚀刻气体。回答下列问题:
(1)NF3的电子式为______,N元素的化合价为______。
(2)F2与NH3直接反应生成NF3的化学方程式为______。
(3)实验室模拟工业上利用电解熔融NH4HF2(NH4F•HF)法制取NF3,阳极为以Ni为基本材料的合金(内含其他金属,忽略镍及其他金属的反应),阴极为碳素钢,电解废液可回收再利用。
①电解时NF3在______极生成;阴极产生的气体是______(填化学式)。
②电解后废液(含Ni少量Fe和Cu的单质及NH4HF2等)可经如下流程进行回收再利用:
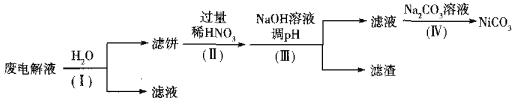
已知该实验条件下,部分金属离子开始沉淀与沉淀完全的pH如下表
| 金属离子 | Ni2+ | Fe2+ | Cu2+ | Fe3+ |
| 开始沉淀时的pH | 7.2 | 7.0 | 4.7 | 1.9 |
| 沉淀完全时的pH | 9.2 | 9.0 | 6.7 | 3.2 |
步骤I的目的是______;步骤Ⅱ滤饼中Ni溶于硝酸的离子方程式为______(HNO3的还原产物为NO);步骤Ⅲ调节pH时,理论上pH应控制的范围是______。
-
铜及其化合物在工农业生产和日常生活中有着广泛的用途。请回答下列问题:
(1)基态铜原子的核外电子排布式为___。
(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2 NF3+3NH4F
NF3+3NH4F
①上述化学方程式中的5种物质所属的晶体类型有__ 填序号
填序号 。
。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
②F、N、O三种元素的第一电离能由大到小的顺序为__ 用元素符号表示
用元素符号表示
(3)铜晶体铜原子的堆积方式为面心立方最密堆积。每个铜原子周围距离最近的铜原子数目为___。
(4)某X原子的外围电子排布式为3s23p5,铜与X形成化合物的晶胞如图所示(黑点代表铜原子)。
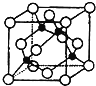
 该晶体的化学式为___。
该晶体的化学式为___。
②已知该晶体的密度为ρg·cm-3,阿伏加德罗常数的数值为NA,则该晶体中晶胞的棱长为__pm(只写计算式 。
。
(5)合成氨工艺的一个重要工序是铜洗,其目的是用铜液 醋酸二氨合铜(I)、氨水
醋酸二氨合铜(I)、氨水 吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:Cu(NH3)2Ac+CO+NH3⇌[Cu(NH3)3CO]Ac(Ac表示醋酸根
吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:Cu(NH3)2Ac+CO+NH3⇌[Cu(NH3)3CO]Ac(Ac表示醋酸根
①如果要提高上述反应的反应速率,可以采取的措施是___。(选填编号)
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
②铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为___。
③NH3的氮原子的杂化类型为___。
-
铜及其化合物在工农业生产和日常生活中有着广泛的用途。请回答下列问题:
(1)基态铜原子的核外电子排布式为___。
(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2 NF3+3NH4F
NF3+3NH4F
①上述化学方程式中的5种物质所属的晶体类型有__ 填序号
填序号 。
。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
②F、N、O三种元素的第一电离能由大到小的顺序为__ 用元素符号表示
用元素符号表示
(3)铜晶体铜原子的堆积方式为面心立方最密堆积。每个铜原子周围距离最近的铜原子数目为___。
(4)某X原子的外围电子排布式为3s23p5,铜与X形成化合物的晶胞如图所示(黑点代表铜原子)。

 该晶体的化学式为___。
该晶体的化学式为___。
②已知该晶体的密度为ρg·cm-3,阿伏加德罗常数的数值为NA,则该晶体中晶胞的棱长为__pm(只写计算式 。
。
(5)合成氨工艺的一个重要工序是铜洗,其目的是用铜液 醋酸二氨合铜(I)、氨水
醋酸二氨合铜(I)、氨水 吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:Cu(NH3)2Ac+CO+NH3⇌[Cu(NH3)3CO]Ac(Ac表示醋酸根
吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:Cu(NH3)2Ac+CO+NH3⇌[Cu(NH3)3CO]Ac(Ac表示醋酸根
①如果要提高上述反应的反应速率,可以采取的措施是___。(选填编号)
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
②铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为___。
③NH3的氮原子的杂化类型为___。
-
人类使用铜和它的合金具有悠久的历史,铜及其化合物在电子工业、材料工业、工农业生产及日常生活方面用途非常广泛。试回答下列问题。
(1)Cu+的核外电子排布式为 。
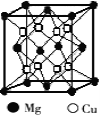
(2)铜镁合金是一种储氢材料,某种铜镁互化物晶胞结构如图,则该互化物的化学式为 。
(3)叠氮化铜[Cu(N3)2]是一种紫黑色粉末,易爆炸,与N3-互为等电子体的分子有 (举2例)。
(4)丁炔铜是一种优良的催化剂,已知:CH≡CH+2HCHO OHC-CH2CH2OH。
OHC-CH2CH2OH。
OHC-CH2CH2OH中碳原子杂化方式有 ,乙炔属于 (填“极性”或“非极性”)分子。
(5)若向盛有CuSO4溶液的试管里加入氨水,首先形成蓝色难溶物,继续加入氨水,难溶物溶解,变成蓝色透明溶液,这时得到一种称为硫酸四氨合铜的物质,该物质的化学式为______________,其中含有的化学键类型有 。
-
人类使用铜和它的合金具有悠久的历史,铜及其化合物在电子工业、材料工业、工农生产及日常生活方面用途非常广泛。试回答下列问题。
(1)Cu+的核外电子排布式为___________________________________;
(2)铜镁合金是一种储氢材料,某种铜镁互化物晶胞结构如图,则该互化物的化学式为___________;

(3)叠氮化铜[Cu(N3)2]是一种紫黑色粉末,易爆炸,与N3-互为等电子体的分子有___________(举2例).
(4)丁炔铜是一种优良的催化剂,已知:CH≡CH+2HCHO OHC-CH2CH2OH;
OHC-CH2CH2OH;
OHC-CH2CH2OH中碳原子杂化方式有___________,乙炔属于___________(填“极性”或“非极性”)分子.
(5)若向盛有CuSO4溶液的试管里加入氨水,首先形成蓝色难溶物,继续加入氨水,难溶物溶解,变成蓝色透明溶液,这时得到一种称溶质的化学式为___________,其中含有的化学键类型有______________________;
(6)已知铜镁互化物晶胞参数为apm,则该晶胞的密度为_______________。
-
(13分)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素原子的物质的量之比为__________.
(2)写出该反应的化学方程式____________________________________________.
若反应中生成0.2 mol HNO3,转移的电子数目为________个.
(3) 三氟化氮可由氨气和氟气反应得到:4NH3+3F2=NF3+3NH4F ,据题意推测 NF3、F2、NO三种气体中,氧化性由弱到强的顺序为____________________
(4)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现.你判断该气体泄漏时的现象是___________________________________________________.
(5)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外,还肯定有____________________________(填化学式).
-
三氟化氮(NF3)是一种无色、无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有HF、NO和HNO3,请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素原子的物质的量之比为________。
(2)写出该反应的化学方程式:____________________________________。
若反应中生成0.2 mol HNO3,转移的电子数目为________个。
(3)三氟化氮可由氨气和氟气反应得到:4NH3+3F2=NF3+3NH4F。据题意推测NF3、F2、NO三种气体中,氧化性由弱到强的顺序为______________。
(4)NF3是一种无色、无味的气体,一旦NF3在空气中泄漏,却还是易于发现。你判断该气体泄漏时的现象是___________________________________________________。
(5)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外,还肯定有________ (填化学式)。
-
已知A为淡黄色固体,T、R 为两种常见的用途广泛的金属单质,D具有磁性的黑色晶体,C是无色无味的气体,M为红褐色固体。回答相关问题
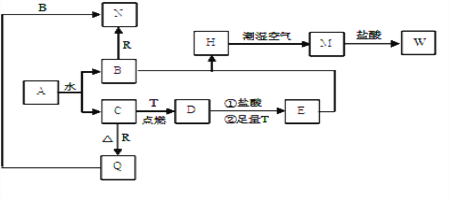
(1)写出D的化学式: ____________
(2)写出A的电子式: _____________
(3)H在潮湿空气中变为M的现象是:______________化学方程式为: ________________
(4)B与R反应的化学方程式为: __________________________
(5)向沸水中加入W饱和溶液,可制得一种红褐色透明液体,区别该液体和溶液W的简单实验方法是 ____________________
=___。[已知Ksp(Ag2SO4)=l.2×10-5,Ksp(Ag2N2O2)=4.0×10-9]








