-
化学与我们的生产、生活密切相关。下列说法错误的是
A.二氧化硫有毒,严禁将其添加到任何食品和饮料中
B.条形码扫描器中的光敏二极管使用的主要是半导体材料
C.“雨后彩虹”“海市蜃楼”既是一种光学现象,也与胶体的知识有关
D.硅橡胶既能耐高温又能耐低温,广泛应用于航天航空工业
难度: 中等查看答案及解析
-
下列微粒的空间构型不是平面形三角形的是
A.BF3 B.CO32- C.PCl3 D.CH3+
难度: 简单查看答案及解析
-
有机物Y(乙酰氧基胡椒酚乙酸酯)具有抗氧化、抗肿瘤作用,可由化合物X在一定条件下合成,下列说法错误的是
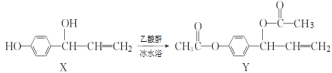
A.X转化成Y为取代反应
B.X、Y分子中含有的手性碳原子数不相同
C.1molX与溴水充分反应,最多消耗Br2的物质的量为3mol
D.1molY与NaOH溶液充分反应,最多消耗NaOH的物质的量为3mol
难度: 中等查看答案及解析
-
根据下列操作和现象所得到的结论正确的是
选项
操作和现象
结论
A
将石蜡油蒸汽通过炽热的碎瓷片,再将生成的气体通入溴水中,溴水褪色
石蜡油催化裂解生成不饱和烃
B
将湿润的KI-淀粉试纸置于集满红棕色气体的集气瓶口,试纸变蓝
该气体为Br2
C
溴乙烷与氢氧化钠乙醇溶液共热,生成气体通入酸性高锰酸钾溶液中,溶液褪色
有乙烯生成
D
将Na2SO3配成溶液,向溶液中加入用盐酸酸化的Ba(NO3)2溶液,产生白色沉淀
Na2SO3已变质
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数值,下列说法正确的是
A.0.1molKHSO4晶体中含有H+数为0.1NA
B.标准状况下,5.6LSO3分子中含有的电子总数为10NA
C.在50g质量分数为46%的乙醇水溶液中,含氢原子总数为3NA
D.33.6gFe与足量的水蒸气加热充分反应,转移电子数为1.6NA
难度: 中等查看答案及解析
-
某工厂采用如图装置处理化石燃料开采、加工过程产生的H2S废气,已知电解池中的两个电极均为惰性电极。下列说法错误的是
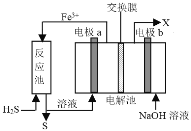
A.电极a电极反应式为Fe2+- e-=Fe3+
B.该装置能实现由H2S转化为S和H2
C.若交换膜为质子交换膜,则NaOH溶液的浓度逐渐变大,需要定期更换
D.若交换膜为阳离子交换膜,b电极区会产生红褐色沉淀
难度: 中等查看答案及解析
-
海冰是海水冻结而成的咸水冰,海水冻结时,部分来不及流走的盐分(设以NaCl为主)以卤汁的形式被包围在冰晶之间,形成“盐泡”,其大致结钩如图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。下列说法错误的是
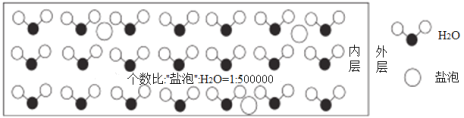
A.海冰的坚固程度不如淡水冰
B.海冰内层“盐泡”越多,密度越小
C.海冰内层NaCl的浓度约为10-4 mol·L−1 (设冰的密度为0.9g·cm−3)
D.海冰冰龄越长,内层的“盐泡”越少
难度: 中等查看答案及解析
-
CuSO4是一种重要的化工原料,其制备途径及性质如图所示(假设恰好完全反应)。下列说法错误的是
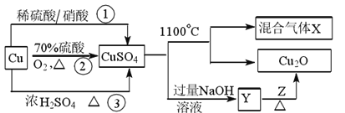
A.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3∶2
B.Z可以是葡萄糖
C.混合气体中一定有O2,1 mol CuSO4完全反应生成O2为0.5 mol
D.相对于途径①、③,途径②更好地体现了绿色化学思想
难度: 中等查看答案及解析
-
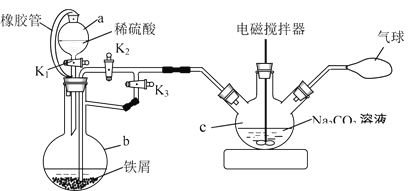
实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。下列说法错误的是
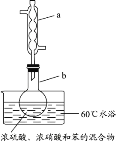
A.仪器a的作用是冷凝回流,下口为进水口
B.水浴加热的优点为使反应物受热均匀、容易控制温度
C.浓硫酸、浓硝酸和苯混合时,应先向浓硝酸中缓缓加入浓硫酸,待冷却至室温后,再将混合酸逐滴滴入苯中
D.反应完全后,用仪器a蒸馏得到产品
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,W的核外电子数与X、Z的最外层电子数之和相等,Y的原子序数是Z的最外层电子数的2倍,由W、X、Y三种元素形成的化合物M的结构如图所示。下列说法错误的是
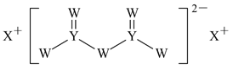
A.气态氢化物的稳定性:Z>Y
B.W和Y形成的晶体为共价晶体
C.Y单质的熔点低于X单质
D.化合物M中W、Y都满足8电子稳定结构
难度: 中等查看答案及解析
-
已知:连苯三酚的碱性溶液能定量吸收O2,CuCl的盐酸溶液能定量吸收CO,且易被O2氧化。拟设计实验方案,采用上述两种溶液和KOH溶液逐一吸收混合气体(由CO2、CO、N2和O2组成)的相应组分。有关该方案设计,下列说法正确的是
A.CO的吸收必须在吸收O2后进行,因为CuCl的盐酸溶液会被O2氧化
B.采用上述3种吸收剂,气体被逐一吸收的顺序是O2、CO和CO2
C.其他两种吸收剂不变,O2的吸收剂可以用灼热的铜网替代
D.在3种气体被逐一吸收后,导出的气体为纯净的N2
难度: 中等查看答案及解析
-
用0.1000 mol·L−1 NaOH溶液滴定20.00 mL 0.1000 mol·L−1的H3A溶液的滴定曲线如图所示。己知H3A的pKa1、pKa2、pKa3分别为2、7和12(pKa=-lgKa),下列说法正确的是
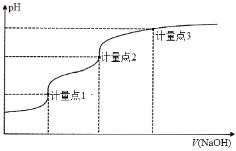
A.滴定前溶液pH值约为3
B.计量点1时,可以用甲基橙作为指示剂
C.到达计量点2时,溶液中存在c(Na+)=c(H2A-)+2c(HA2-)+3c(A3-)
D.到达计量点3时,微热溶液,
会增大
难度: 中等查看答案及解析
-
在酸性条件下,黄铁矿(FeS2)催化氧化的反应方程式为2FeS2 + 7O2+ 2H2O = 2Fe2+ + 4SO42− + 4H+。实现该反应的物质间转化如图所示。下列分析正确的是

A.反应Ⅰ中Fe(NO)2+作氧化剂
B.在酸性条件下,黄铁矿催化氧化中NO作中间产物
C.由反应Ⅱ可知,氧化性:Fe3+>SO42−
D.反应Ⅲ的离子方程式为Fe2+ + NO =Fe(NO)2+,该反应是氧化还原反应
难度: 中等查看答案及解析
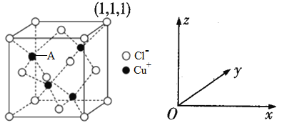
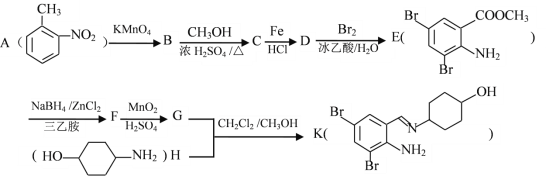
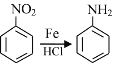
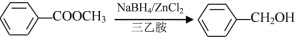
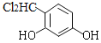 为原料制备
为原料制备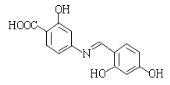 的合成路线 __(其他试剂任选)。
的合成路线 __(其他试剂任选)。