-
下列物质在化学反应中只能做还原剂的是
A. 浓H2SO4 B. Cl2 C. Fe D. HNO3
难度: 简单查看答案及解析
-
2017年7月,清华大学宁存政教授课题组在硅基纳米激光器和光放大器研究上获得重大突破,对世界科技具有重要意义。下列分散系中分散质的微粒直径与纳米级(1-100nm)粒子具有相同数量级的是
A.溶液 B.胶体 C.悬浊液 D.乳浊液
难度: 简单查看答案及解析
-
下列类型的反应,一定属于氧化还原反应的是
A.复分解反应 B.分解反应
C.化合反应 D.置换反应
难度: 简单查看答案及解析
-
下列物质中,不能用浓硫酸干燥的是
A.NH3 B.CO2 C.Cl2 D.SO2
难度: 简单查看答案及解析
-
下列工业生产的反应原理不涉及氧化还原反应的是
A.铝热反应冶炼铁:Fe2O3+2Al
2Fe+Al2O3
B.工业上以NH3、CO2、饱和食盐水为原料生产NaHCO3:NH3+CO2+NaCl+H2O=NaHCO3↓+NH4Cl
C.硝酸厂以氨气为原料制取硝酸:NH3→NO→NO2→HNO3
D.工业电解Al2O3制备金属铝:2Al2O3(熔融)
4Al+3O2↑
难度: 简单查看答案及解析
-
下列叙述错误的是
A.自然界中的硫都是以化合态存在
B.硫既有氧化性,又有还原性
C.附着在试管壁上的硫,可用CS2洗涤
D.硫黄主要用于制造硫酸、化肥等
难度: 简单查看答案及解析
-
最新研究发现,人体内自身产生的NO能促进全身血液循环,预防动脉粥样硬化,恢复血管柔软性和弹性。下列有关NO的叙述中,正确的是
A.NO能溶于水,不能用排水法收集
B.NO暴露在空气中,气体由无色变为红棕色,发生的是物理变化
C.“雷雨发庄稼”的谚语涉及到NO,生成NO的过程属于自然固氮
D.由信息知人可吸入大量NO,有利于身体健康
难度: 简单查看答案及解析
-
下列有关物质用途的说法中,不正确的是
A.NH4NO3常用作氮肥 B.Fe2O3做红色颜料
C.氨可用作制冷剂 D.用SO2可漂白馒头
难度: 简单查看答案及解析
-
下列有关浓硫酸、浓盐酸、浓硝酸的认识不正确的是
A.浓硫酸、浓硝酸与金属反应时,分别是S、N得电子
B.蔗糖与浓硫酸混合后,白色蔗糖固体逐渐变成黑色疏松的碳,体现了浓硫酸的脱水性
C.浓盐酸、浓硝酸具有挥发性,而浓硫酸难挥发
D.常温下,浓硫酸或浓HNO3中投入Fe片,均会产生大量的气体
难度: 简单查看答案及解析
-
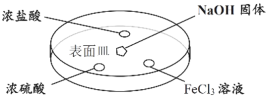
实验室中的药品常按物质的性质、类别等有规律地摆放。现有部分药品按某种规律摆放在实验桌上,如下图。做“硫酸的性质”的实验时,某同学取用BaCl2溶液后,应把它放回的位置是 ( )

A.A B.B C.C D.D
难度: 简单查看答案及解析
-
工业上用黄铁矿(FeS2)为原料制备硫酸的流程如下:
黄铁矿(FeS2)
SO2
气体B
硫酸
关于工业制硫酸的说法不正确的是
A.煅烧时FeS2发生氧化反应 B.A可以是空气
C.步骤②产物中有SO3 D.步骤③发生了氧化还原反应
难度: 简单查看答案及解析
-
下列物质长期露置于空气中会变质,且变质过程中涉及氧化还原反应的是
①Na ②NaOH ③FeSO4 ④氯水
A.①② B.②③ C.①③④ D.②③④
难度: 简单查看答案及解析
-
最近,科学家开发出一种低成本光伏材料——蜂窝状石墨烯。生产原理是:Na2O+2CO
Na2CO3+C(石墨烯),然后除去Na2CO3,即可制得蜂窝状石墨烯。下列说法不正确的是
A.石墨烯与金刚石互为同素异形体
B.该生产石墨烯的反应中CO只体现了还原性
C.Na2O属于碱性氧化物,Na2CO3属于盐
D.自然界中碳元素有游离态和化合态两种存在形式
难度: 简单查看答案及解析
-
化学与科技、社会、生产有密切联系,下列说法不正确的是
A.减少燃煤的使用可减少二氧化硫的排放,减少酸雨的危害
B.铵盐具有受热易分解的性质,在储存铵态氮肥时,应密封包装并放在阴凉通风处
C.84消毒液与洁厕灵(其中含有盐酸)可以混合使用
D.二氧化氯(ClO2)具有氧化性,可用于自来水的杀菌消毒
难度: 简单查看答案及解析
-
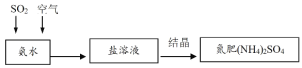
只用一种试剂就能将NH4Cl、(NH4)2SO4、NaCl、Na2SO4四种溶液区别,这种试剂是
A.NaOH溶液 B.AgNO3溶液
C.Ba(OH)2溶液 D.BaCl2溶液
难度: 简单查看答案及解析
-
下列离子方程式不正确的是
A.用稀盐酸除铁锈:Fe2O3+6H+=2Fe3++3H2O
B.Cl2通入水中:Cl2+H2O⇌H++Cl-+HClO
C.铜与浓硝酸反应生成红棕色气体:3Cu+8H++2NO3-=3Cu2++2NO2↑+4H2O
D.实验室用MnO2和浓盐酸制Cl2:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
难度: 中等查看答案及解析
-
下列说法不正确的是
A.氨水使酚酞溶液变红是因为溶液中NH3∙H2O电离出OH-
B.KNO3溶于水电离出K+和NO3-
C.电离时生成的阳离子有H+的化合物不一定是酸
D.SO2溶于水能导电,所以SO2是电解质
难度: 简单查看答案及解析
-
下列关于Na2O2的说法不正确的是
A.Na2O2中Na与O的化合价分别为+1,-1
B.Na2O2与水反应,Na2O2既是氧化剂,又是还原剂
C.Na2O2投入NaHSO3溶液,产生气泡,生成Na2SO3溶液
D.Na2O2投入酚酞溶液中,可以观察到有气体产生,溶液变红的现象
难度: 简单查看答案及解析
-
设NA代表阿伏加德罗常数的数值,下列说法不正确的是
A.常温常压下,2 g氢气所含原子数目为2NA
B.1 mol NH4+含有的电子数为10 NA
C.一定量铁粉与水蒸气反应生成1 g氢气,反应中转移的电子数为NA
D.标准状况下,0.3 mol NO2通入足量水中完全反应,生成气体体积约为4.48 L
难度: 简单查看答案及解析
-
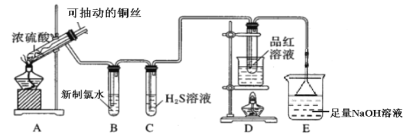
下列实验方案能达到实验目的的是(部分夹持装置已略去)
A.
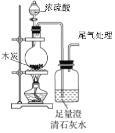 验证木炭和浓硫酸反应生成CO2
验证木炭和浓硫酸反应生成CO2B.
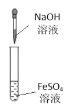 实验室制备Fe(OH)2并能较长时间观察到白色固体
实验室制备Fe(OH)2并能较长时间观察到白色固体C.
 实验室制备和收集氨气并验满
实验室制备和收集氨气并验满D.
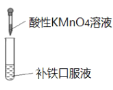 证明补铁口服液中存在+2价的铁
证明补铁口服液中存在+2价的铁难度: 简单查看答案及解析
-
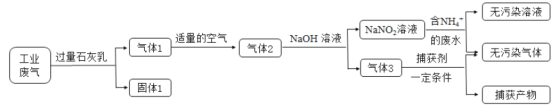
食盐中的碘以碘酸钾(KlO3)形式存在,可根据反应:IO3-+5I-+6H+=3I2+3H2O验证食盐中存在IO3-。根据上述反应,下列说法错误的是
A.IO3-作氧化剂,发生还原反应
B.I2既是氧化产物又是还原产物
C.该条件下氧化性:IO3->I2
D.每生成3 mol I2,转移电子的物质的量为6 mol
难度: 简单查看答案及解析