-
习近平总书记在上海考察时指出,垃圾分类工作就是新时尚。下列垃圾分类错误的是
A
B
C
D
垃圾


分类




A.A B.B C.C D.D
难度: 中等查看答案及解析
-
硒(Se)元素是人体必需的微量元素之一。下列说法正确的是
A.硒的摄入量越多对人体健康越好 B.SeO32-空间构型为正四面体
C.H2Se的熔沸点比H2S高 D.H2SeO4的酸性比H2SO4强
难度: 中等查看答案及解析
-
相对分子质量约为4000的聚乙二醇具有良好的水溶性,是一种缓泻剂。聚乙二醇可由环氧乙烷在酸性条件下聚合而成(
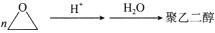 )。下列说法正确的是
)。下列说法正确的是A.环氧乙烷在酸性条件下发生加聚反应制得聚乙二醇
B.聚乙二醇的结构简式为
C.相对分子质量约为4000的聚乙二醇的聚合度n≈67
D.聚乙二醇能保持肠道水分的原因是其可和H2O分子间形成氢键
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,1LC2H5OH完全燃烧后生成的CO2分子个数约为
B.20gD2O与20gH218O含有的中子数均为10NA
C.1mol·L-1Al(NO3)3溶液中含有3NA个NO3-
D.50mL12mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
难度: 简单查看答案及解析
-
含元素碲(Te)的几种物质存在如图所示转化关系。下列说法错误的是
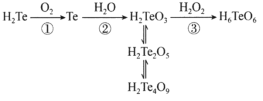
A.反应①利用了H2Te的还原性
B.反应②中H2O作氧化剂
C.反应③利用了H2O2的氧化性
D.H2Te2O5转化为H2Te4O9发生了氧化还原反应
难度: 中等查看答案及解析
-
微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置,某微生物燃料电池的工作原理如图所示,下列说法错误的是
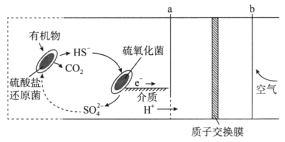
A.b电极发生还原反应:4H++O2+4e-=2H2O
B.电路中有4mol电子发生转移,大约消耗标准状况下22.4L空气
C.维持两种细菌存在,该装置才能持续将有机物氧化成CO2并产生电子
D.HS-在硫氧化菌作用下转化为
的反应是
=
难度: 中等查看答案及解析
-
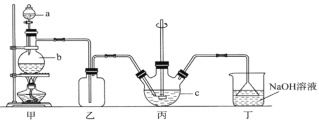
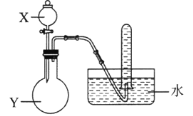
用所给试剂与图示装置能够制取相应气体的是(夹持仪器略)
A
B
C
D
X中试剂
浓盐酸
双氧水
浓硫酸
浓氨水
Y中试剂
KMnO4
MnO2
Cu
NaOH
气体
Cl2
O2
SO2
NH3
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
氧氟沙星是常用抗菌药物,其结构简式如图所示。下列有关氧氟沙星的叙述错误的是
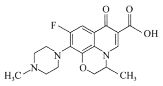
A.能发生加成、取代、还原等反应
B.分子内有3个手性碳原子
C.分子内存在三种含氧官能团
D.分子内共平面的碳原子多于6个
难度: 中等查看答案及解析
-
短周期元素a、b、c、d的原子序数依次增大,在下列转化关系中,甲、乙、丙、丁、戊为上述四种元素组成的二元或三元化合物。其中A为d元素组成的单质,常温下乙为液体,丁物质常用于消毒、漂白。下列说法错误的是
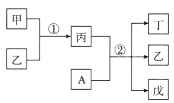
A.简单离子半径:c>b
B.丙中既有离子键又有极性键
C.b、c形成的化合物中阴、阳离子数目比为1:2
D.a、b、d形成的化合物中,d的杂化方式是sp3
难度: 中等查看答案及解析
-
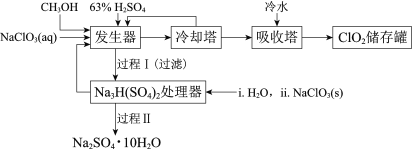
图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。下列说法错误的是
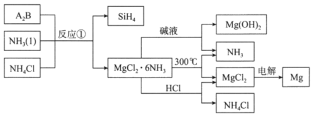
A.A2B的化学式为Mg2Si
B.该流程中可以循环使用的物质是NH3和NH4Cl
C.利用MgCl2·6NH3制取镁的过程中发生了化合反应、分解反应
D.分别将MgCl2溶液和Mg(OH)2悬浊液加热、灼烧,最终得到的固体相同
难度: 中等查看答案及解析
-
下列“实验现象”和“结论”都正确且有因果关系的是
选项
操作
实验现象
结论
A
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热
融化后的液态铝滴落下来
金属铝的熔点低
B
用铂丝蘸取少量某溶液进行焰色反应
火焰呈黄色
该溶液中含有钠盐
C
向盛有酸性高锰酸钾溶液的试管中通入足量的乙烯后静置
溶液的紫色逐渐褪去,静置后溶液分层
乙烯发生氧化反应
D
将20℃ 0.5 mol·L-1 Na2CO3溶液加热到60℃,用pH传感器测定pH
溶液的pH逐渐减小
Kw改变与水解平衡移动共同作用的结果
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
常温下,向某浓度的二元弱酸H2C2O4溶液中逐滴加入NaOH溶液,pC与溶液pH的变化关系如图所示(pC=-lgx,x表示溶液中溶质微粒的物质的量浓度)。下列说法正确的是
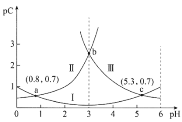
A.常温下,H2C2O4的Ka1=100.8
B.pH=3时,溶液中
C.pH由0.8增大到5.3的过程中,水的电离程度逐渐增大
D.常温下,随着pH的增大,
的值先增大后减小
难度: 困难查看答案及解析
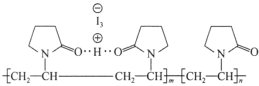 (图中虚线表示氢键)
(图中虚线表示氢键)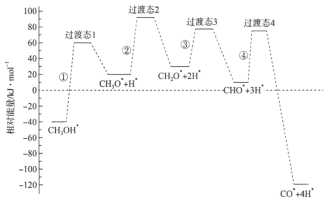
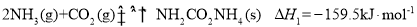
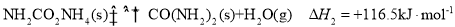
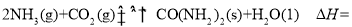 __________kJ/mol
__________kJ/mol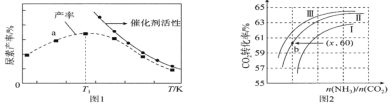
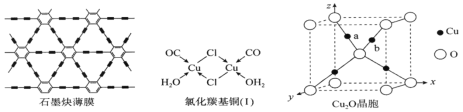
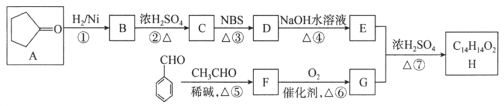
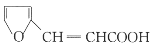 )是一种医治血吸虫病的药物 呋喃丙胺的原料。设计以
)是一种医治血吸虫病的药物 呋喃丙胺的原料。设计以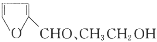 为原料合成呋喃丙烯酸的合成路线(无机试剂任选)。_____________。
为原料合成呋喃丙烯酸的合成路线(无机试剂任选)。_____________。