-
新型冠状病毒对人类健康构成严重威胁。下列物质不能用作新型冠状病毒消毒剂的是( )
A.75%酒精 B.次氯酸钠溶液
C.生理盐水 D.过氧乙酸溶液
难度: 简单查看答案及解析
-
用化学用语表示SiO2+4HF=SiF4↑+2H2O中的相关微粒,其中正确的是( )
A.中子数为15的硅原子:
Si
B.氟原子的结构示意图:
C.SiF4的电子式
D.水分子的比例模型:
难度: 简单查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是( )
A.Al2O3具有两性,可用作耐高温材料
B.FeCI3溶液呈酸性,可用于腐蚀电路扳上的Cu
C.Na2O2能吸收CO2产生O2,司用作呼吸面具供氧剂
D.FeS难溶于水,可用于除去废水中的Cu2+
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.澄清透明的酸性溶液中:Fe3+、Cu2+、SCN-、SO42-
B.能使酚酞变红的溶液中:K+、NH4+、Cl-、NO3-
C.
=10-12mol·L-1的溶液中Na+、Al3+、Cl-、SO42-
D.c(HCO3-)=0.1mol·L-1的溶液中:H+、Mg2+、SO42-、NO3-
难度: 中等查看答案及解析
-
用下列实验操作或装置进行相应实验,正确的是( )
A.用图甲所示操作测定NaOH溶液的浓度
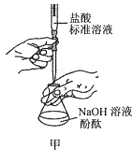
B.用图乙所示操作配制银氨溶液
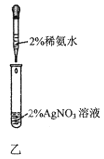
C.用图丙所示装置吸收尾气中的SO2
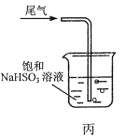
D.用图丁所示装置检验产生的乙烯
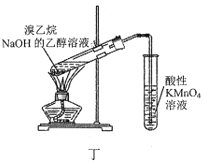
难度: 中等查看答案及解析
-
下列有关化学反应的叙述正确的是( )
A.铝在稀硝酸中发生钝化
B.过量铁粉在Cl2中燃烧制取FeCl2
C.N2与O2在放电条件下化合生成NO2
D.新制Cu(OH)2悬浊液中加入葡萄糖并煮沸,生成Cu2O
难度: 简单查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.NO2溶于水:3NO2+H2O=2H++2NO3-+NO
B.电解饱和食盐水:2Cl-+2H+
Cl2↑+H2↑
C.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
D.向氨水中通入过量CO2:2NH3·H2O+CO2=2NH4++CO32-+H2O
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大。X、Z同主族,Y、W同主族,且X的原子半径小于Y,Y是地壳中含量最高的元索。下列说法正确的是( )
A.原子半径:r(Y)<r(Z)<r(W)
B.Y的气态氢化物的稳定性比w的弱
C.X、Y、Z三种元素形成的化合物中其含有离子键
D.X可分别与Y、W形成含18个电子的分子
难度: 简单查看答案及解析
-
下列物质的转化在给定条件下能实现的是( )
A.Cu2(OH)2CO3(s)
CuCl2(aq)
Cu(s)
B.NaCl(aq)
NaHCO3(s)
Na2CO3(s)
C.Fe(s)
Fe2O3(s)
FeCl3(aq)
D.SiO2(s)
SiCl4(l)
Si(s)
难度: 简单查看答案及解析
-
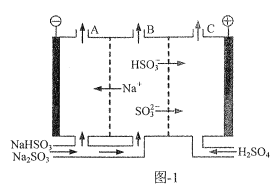
2019年度诺贝尔化学奖授予在锂离子电池发展做出贡献的三位科学家。某浓差电池的原理示意如图所示,可用该电池从浓缩海水中提取LiCl溶液。下列有关该电池的说法不正确的是( )
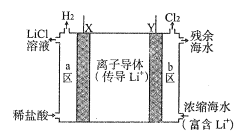
A.该装置可在提取LiCl溶液的同时得电能
B.电子由Y极通过外电路移向X极
C.正极发生的反应为:2H++2e—===H2↑
D.Y极每生成22.4LCl2,有2molLi+从b区移至a区
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.在船身上装锌块是利用牺牲阳极的阴极保护法来避免船体遭受腐蚀
B.反应Hg(l)+H2SO4(aq)=HgSO4(aq)+H2(g)在常温下不能自发进行,则△H<0
C.将纯水加热至较高温度,Kw变大、pH变小、呈酸性
D.在反应KIO3+6HI=KI+3I2+3H2O中,每生成3moII2转移的电子数为6×6.02×1023
难度: 中等查看答案及解析
-
根据下列实验操作和现象能得到相应结论的是( )
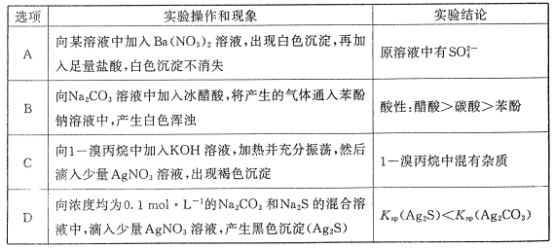
A.A B.B C.C D.D
难度: 中等查看答案及解析
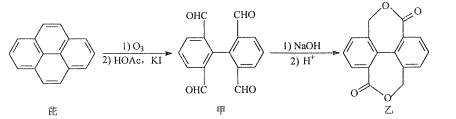
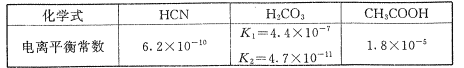
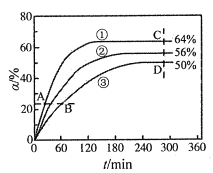
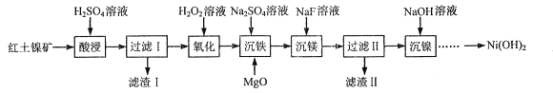
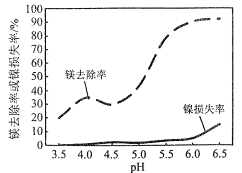
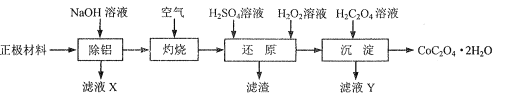
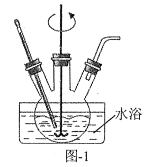
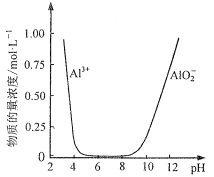
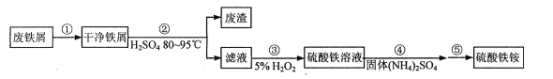
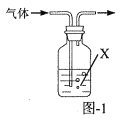
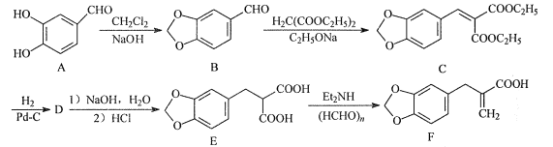
 为原料制备
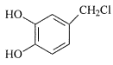
为原料制备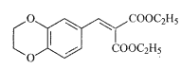 的合成路线流程图___(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图___(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。