-
工业中将含有较多Ca2+、Mg2+的水称为硬水。测定某水域的钙硬度、镁硬度(每升水中含Ca2+或Mg2+的质量,单位mg/L)的过程如下:
①取50.00mL水样,控制溶液的pH=10。以铬黑T为指示剂,用0.01000mol/LEDTA标准溶液滴定硬水中钙和镁的总含量至终点,消耗EDTA标准溶液30.00mL。
②另取50.00mL水样,加入10%NaOH溶液至pH=12.5,加入钙指示剂,用001000mol/LEDTA标准溶液滴定硬水中钙的含量至终点,消耗EDTA标准溶液20.00mL。
已知:Ca2+、Mg2+与EDTA反应的化学汁量比均为1:1。
(1)向硬水中加入石灰,可使Ca2+、Mg2+沉淀,以达到软化硬水的目的,写出Ca(OH)2和Ca(HCO3)2反应的化学方程式:___。
(2)“加入10%NaOH溶液至pH=12.5”的目的是___。
(3)计算该水样的钙硬度、镁硬度(写出计算过程)___。
高三化学综合题中等难度题查看答案及解析
-
我国规定饮用水的硬度不能超过25度.硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其质量折算成CaO的质量.通常把1升水中含有10毫克CaO称为1度.水中的Ca2+和Mg2+可用一定浓度的Y溶液进行滴定,Y跟Ca2+和Mg2+都以等物质的量完全反应.
(1)现取某地区的地下水样品25.0毫升.用0.0100摩/升Y溶液滴定,完全反应时消耗Y溶液15.0毫升.试计算该地下水的硬度,并判断是否符合饮用水标准.
(2)如果每次分析时取的水样都是25.0毫升,为了便于计算.要求每消耗0.50毫升Y溶液即相当于水的硬度为1度.则Y溶液的摩尔浓度应为多少?高三化学解答题中等难度题查看答案及解析
-
天然水里一般含有Ca2+、Mg2+等多种离子。人们把含有较多量Ca2+、Mg2+的水叫做硬水,含有较少量或不含Ca2+、Mg2+的水叫做软水;降低水中Ca2+、Mg2+含量的过程叫做硬水软化。如果硬度太高(含Ca2+、Mg2+的浓度太大)会给生产、生活带来很多不利,因此硬水的软化是水处理的重要方面之一。
离子交换法常用于工业锅炉用水的软化。离子交换剂多种多样,磺化煤(NaR)就是一种阳离子交换剂。
(1)写出用磺化煤软化含Ca2+、Mg2+浓度较高的硬水的化学方程式____________________。
(2)用药剂软化法软化过的水总是含有一定浓度的Ca2+、Mg2+,其原因是_______________。
(3)参考烧水后的锅或壶中结有水垢的现象分析说明,如果用硬度太高的水作锅炉用水,主要的不利因素是________________________________________________________________。
高三化学填空题简单题查看答案及解析
-
天然水里一般含有Ca2+、Mg2+等多种离子。人们把含有较多量Ca2+、Mg2+的水叫做硬水,含有较少量或不含Ca2+、Mg2+的水叫做软水;降低水中Ca2+、Mg2+含量的过程叫做硬水软化。如果硬度太高(含Ca2+、Mg2+的浓度太大)会给生产、生活带来很多不利,因此硬水的软化是水处理的重要方面之一。
离子交换法常用于工业锅炉用水的软化。离子交换剂多种多样,磺化煤(NaR)就是一种阳离子交换剂。
(1)写出用磺化煤软化含Ca2+、Mg2+浓度较高的硬水的化学方程式____________________。
(2)用药剂软化法软化过的水总是含有一定浓度的Ca2+、Mg2+,其原因是_______________。
(3)参考烧水后的锅或壶中结有水垢的现象分析说明,如果用硬度太高的水作锅炉用水,主要的不利因素是________________________________________________________________。
高三化学填空题中等难度题查看答案及解析
-
下列说法中,不正确的是 ( )
A.煮沸暂时硬水后,水的硬度一定降低
B.硬水中加入适量石灰水后,由于生成Mg(OH)2、CaCO3沉淀,水就软化了
C.永久硬水主要是由含有Ca2+、Mg2+的硫酸盐和氯化物形成的,加热煮沸是不能软化的
D.如果用HR型离子交换树脂软化硬水,则发生的交换反应可以表示为Ca2++2HR=CaR2+2H+
高三化学选择题简单题查看答案及解析
-
用石灰纯碱法软化硬水时,加入石灰的作用是( )
A.只能降低水中的永久硬度
B.能同时降低水中的永久硬度和暂时硬度
C.可把部分Ca2+所形成的硬度转变为Mg2+形成的硬度
D.可把部分Mg2+所形成的硬度转变为Ca2+形成的硬度高三化学选择题中等难度题查看答案及解析
-
下列叙述中正确的是( )
A.不含Ca2+、Mg2+的水叫做软水
B.只要含有Ca2+、Mg2+的水就是硬水
C.只含Ca2+或Mg2+一种离子的水是暂时硬水
D.永久硬水用加热方法不能使其软化
高三化学选择题简单题查看答案及解析
-
下列有关硬水及其软化的说法中错误的是( )
A.离子交换法可以软化硬水
B.硬水中含有较多Ca2+、Mg2+
C.生产、生活使用的天然水必须经软化
D.加热可使暂时硬水中的Ca2+生成CaCO3沉淀高三化学选择题中等难度题查看答案及解析
-
下列有关硬水及其软化的说法中错误的是( )
A.离子交换法可以软化硬水
B.硬水中含有较多Ca2+,Mg2+
C.生产、生活使用的天然水必须经软化
D.加热可使硬水中的Ca(HCO3)2生成CaCO3沉淀
高三化学单选题简单题查看答案及解析
-
EDTA(乙二胺四乙酸)是一种能与Ca2+、Mg2+等结合的螯合剂。某高三研究性学习小组在实验室制备EDTA,并用其测定某地下水的硬度。制备EDTA的实验步骤如下:
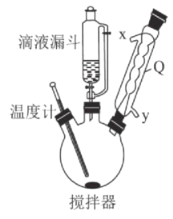
步骤1:称取94.5g(1.0mol)ClCH2COOH于1000mL三颈烧瓶中(如图),慢慢加入50%Na2CO3溶液,至不再产生无色气泡;
步骤2:加入15.6g(0.26mol)H2NCH2CH2NH2,摇匀,放置片刻,加入2.0 mol/L NaOH溶液90mL,加水至总体积为600mL左右,温度计50℃加热2h;
步骤3:冷却后倒入烧杯中,加入活性炭脱色,搅拌、静置、过滤。用盐酸调节滤液至pH=1,有白色沉淀生成,抽滤,干燥,制得EDTA。
测地下水硬度:
取地下水样品25.00mL进行预处理后,用EDTA进行检测。实验中涉及的反应有M2+ (金属离子)+Y4-(EDTA)=MY2-;M2+(金属离子)+EBT(铬黑T,蓝色)==MEBT(酒红色);MEBT+Y4-(EDTA)=MY2-+EBT(铬黑T)。
请回答下列问题:
(1)步骤1中发生反应的离子方程式为__________。
(2)仪器Q的名称是____________,冷却水从接口_______流出(填“x”或“y”)
(3)用NaOH固体配制上述NaOH溶液,配制时使用的仪器有天平、烧杯、玻璃棒、______和_______,需要称量NaOH固体的质量为______。
(4)测定溶液pH的方法是___________。
(5)将处理后的水样转移到锥形瓶中,加入氨水-氯化铵缓冲溶液调节pH为10,滴加几滴铬黑T溶液,用0.0100mol·L-1EDTA标准溶液进行滴定。
①确认达到滴定终点的现象是____________。
②滴定终点时共消耗EDTA溶液15.0mL,则该地下水的硬度=____________(水硬度的表示方法是将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量,通常把1L水中含有10 mg CaO称为1度)
③若实验时装有EDTA标准液的滴定管只用蒸馏水洗涤而未用标准液润洗,则测定结果将_____(填“偏大“偏小”或“无影响”)。
高三化学实验题中等难度题查看答案及解析