-
生铁的熔点是1100~1200℃,则可推断纯铁的熔点是
A.1085℃ B.1160℃ C.1200℃ D.1535℃
难度: 简单查看答案及解析
-
对
中各数字的描述错误的是
A.8:质子数 B.16:质量数 C.2-:电子数 D.-2:化合价
难度: 简单查看答案及解析
-
不能鉴别黄色的溴水和Fe2(SO4)3溶液的是
A.NaOH溶液 B.CCl4 C.AgNO3溶液 D.淀粉KI试纸
难度: 简单查看答案及解析
-
下列过程中共价键被破坏的是
A.氯气溶于水 B.碘升华 C.乙醇溶于水 D.NaOH溶于水
难度: 中等查看答案及解析
-
氮元素被氧化的反应是
A.工业合成氨 B.闪电时,空气中产生NO
C.常温下,浓硝酸使铁钝化 D.实验室检验NH4+
难度: 简单查看答案及解析
-
石油分馏得到的石蜡,其中的有色物质常用氯气漂白,该过程中少量的石蜡会与氯气发生
A.取代反应 B.加成反应 C.还原反应 D.消除反应
难度: 简单查看答案及解析
-
向FeCl3和BaCl2的混合溶液中通入SO2,有沉淀生成,此沉淀是
A.Fe(OH)3 B.FeS C.S D.BaSO4
难度: 中等查看答案及解析
-
决定气体摩尔体积的主要因素是
A.微粒的大小 B.微粒间的距离 C.微粒的种类 D.微粒的数目
难度: 简单查看答案及解析
-
84消毒液(pH约为12,有效成分为NaClO)露置在空气中发生变质,此过程中
A.未发生复分解反应 B.Na、O化合价未变
C.碱性逐渐增强 D.会产生氧气
难度: 中等查看答案及解析
-
储存浓H2SO4的铁罐外口易出现腐蚀,主要原因是硫酸具有
A.脱水性和吸水性 B.强氧化性和脱水性
C.吸水性和酸性 D.难挥发性和酸性
难度: 中等查看答案及解析
-
对α-甲基苯乙烯(
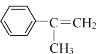 )的分析,正确的是
)的分析,正确的是A.沸点比苯低 B.聚合反应产物的分子式为:(C9H10)n
C.易溶于水 D.分子中所有的原子处于同一平面
难度: 中等查看答案及解析
-
下列试剂和条件下,
不能发生化学反应的是
A.氧化铜,加热 B.酸性高锰酸钾溶液,常温
C.浓硫酸,加热 D.HBr,加热
难度: 中等查看答案及解析
-
已知:①I2(g)+H2(g)
2HI(g)+26.5kJ、②I2(s)+H2(g)
2HI(g)-9.5kJ,下列分析正确的是
A.①是放热反应,无需加热即可发生
B.②需持续不断加热才能发生反应
C.I2(g)和I2(s)的能量关系如图所示
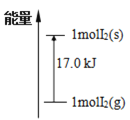
D.1molI2(s)和1molH2(g)的能量之和比2molHI(g)能量高
难度: 中等查看答案及解析
-
表面有氧化膜的铝片,投入到足量的NaOH溶液中,充分反应
A.n(还原剂):n(氧化剂)=1:3 B.Al(OH)3表现了弱碱性
C.氧化剂是NaOH D.n(生成AlO2-):n(生成H2)=2:3
难度: 中等查看答案及解析
-
如图是家用消毒液发生器,下列分析错误的是

A.碳棒a是阴极
B.反应中碳棒b附近溶液显酸性
C.电子由碳棒a经溶液流向碳棒b
D.发生器中的总反应:NaCl+H2O
NaClO+H2↑
难度: 中等查看答案及解析
-
用FeCl3溶液蚀刻铜箔回收铜的一种流程如图所示。下列叙述正确的是
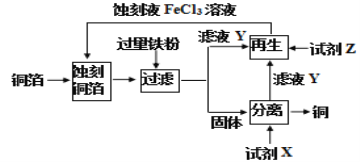
A.蚀刻铜箔的离子方程式:2Cu+Fe3+→2Cu2++Fe2+ B.试剂X是盐酸或稀硝酸
C.滤液Y呈浅绿色 D.试剂Z只能是氯水
难度: 中等查看答案及解析
-
向H2SO4和NH4Al(SO4)2的混合溶液中滴加NaOH溶液,不可能发生
A.H++OH-→H2O B.Al3++4NH3·H2O→AlO2-+4NH4++2H2O
C.NH4++OH-→NH3·H2O D.Al(OH)3+OH-→AlO2-+2H2O
难度: 中等查看答案及解析
-
固定体积的密闭容器中,发生:4NH3(g)+5O2(g)
4NO(g)+6H2O(g),能判断该反应达到平衡状态的依据是
A.5υ正(O2)=4υ逆(NO) B.容器内气体密度不再变化
C.c(NH3)不再变化 D.c(NH3)=1.5c(H2O)
难度: 中等查看答案及解析
-
某纯碱工业的生产流程如图,判断错误的是

A.该流程是索尔维法制碱
B.X是NaCl
C.Y是Na2CO3
D.Z是NH4Cl
难度: 中等查看答案及解析
-
0.5mol·L-1CH3COONa溶液和水的pH随温度的变化如图所示,下列分析错误的是
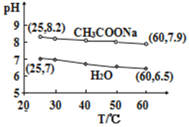
A.25℃,CH3COONa溶液的pH=8.2,显碱性
B.60℃,H2O中c(H+)=1×10-6.5mol·L-1,呈中性
C.60℃,CH3COONa溶液中c(OH-)=1×10-5.1mol·L-1
D.升高温度,CH3COONa溶液水解程度和pH都减小
难度: 中等查看答案及解析
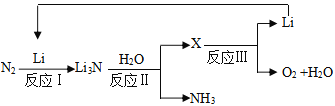

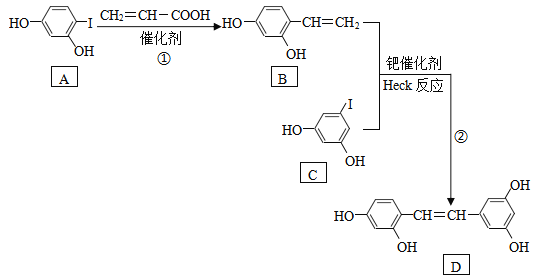
 ,写出合成路线。(无机试剂任选)_______________________(合成路线的表示方式为:
,写出合成路线。(无机试剂任选)_______________________(合成路线的表示方式为: )。
)。