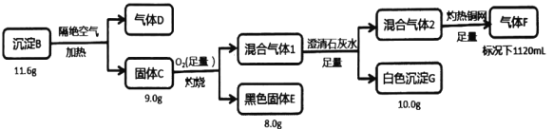
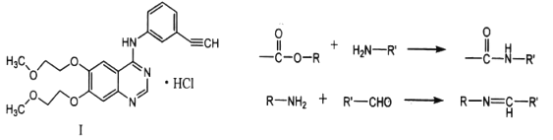
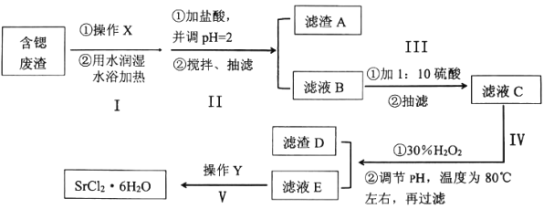
-
下列属于强电解质的共价化合物是( )
A.H2SO4 B.NaCl C.CH3COOH D.Mg3N2
难度: 简单查看答案及解析
-
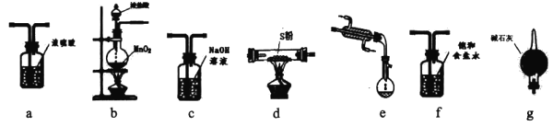
配制一定物质的量浓度的溶液的实验中可不选用的仪器是( )
A.
B.
 C.
C.D.
难度: 简单查看答案及解析
-
下列属于有机物,且水溶液能导电的是( )
A.碳化硅 B.乙酸 C.葡萄糖 D.乙醇
难度: 简单查看答案及解析
-
洁厕灵和84消毒液混合使用时发生反应:NaC1O+2HCl=NaCl+Cl2↑+H2O,生成有毒的氯气。下列说法正确的是( )
A.84消毒液的有效成分是HCl
B.氯气既是氧化产物又是还原产物,氯化钠是还原产物
C.HCl只表现还原性
D.若有0.lmolHCl被氧化,生成的氯气在标准状况下的体积约为2.24L
难度: 简单查看答案及解析
-
下列物质名称或化学式正确的是( )
A.Na2SiO3:水玻璃
B.
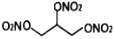 :硝化甘油
:硝化甘油C.芒硝:Na2SO4•7H2O
D.(CH3)2CHCH2C(CH3)3:2,4,4-三甲基戊烷
难度: 中等查看答案及解析
-
下列表示正确的是( )
A.甲醛的分子式:HCHO
B.聚氯乙烯的结构式:—H2C—CHCl—
C.34S2-的结构示意图:
D.丙烷分子的球棍模型:
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.金刚石和C70互为同素异形体,熔点和硬度都很高
B.15N和14C中子数相同,属于两种核素
C.丙烯酸(CH2=CHCOOH)和油酸互为同系物
D.CH2(NH2)COOH和CH3CH2NO2互为同分异构体
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.FeSO4常用于制取净水剂,原因是溶于水时形成具有净水作用的氢氧化亚铁胶体
B.纳米铁粉和FeS都可以去除水体中的Cu2+、Hg2+等离子,其原理不相同
C.SO2具有还原性,可用KMnO4溶液测定食品中SO2残留量
D.利用碳酸钠溶液可消除燃煤烟气中的SO2
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.亚硝酸钠溶液具有防腐作用,可用来浸泡新鲜瓜果
B.我国古代就已采用加热胆矾或绿矾的方法制取硫酸
C.红宝石是含有少量金属氧化物的刚玉,主要成分为二氧化硅
D.Na3AlF6溶液中滴加lmol/L氨水至过量会产生白色沉淀
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.淀粉、油脂、亚油酸的组成元素中均只含C、H、O
B.工业生产石油化工中的重要基础原料乙烯,主要原理是发生消去反应
C.3M防颗粒物口罩含有聚丙烯,聚丙烯属于高分子,不能使酸性高锰酸钾溶液褪色
D.将植物的秸杆、枝叶、杂草和人畜粪便加入沼气发酵池中,一定条件下生成沼气,属于生物质能的生物化学转换
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.蒸馏实验时,若冷凝管内壁上出现馏出物固体,此时可以减小通入冷却水的流速
B.浓硝酸应保存在带磨口玻璃塞的棕色细口试剂瓶中
C.滴瓶中的滴管在加完药品后应将滴管洗净后再放回原瓶
D.摩尔盐制备实验中,向FeSO4溶液中加入少量稀硫酸抑制Fe2+的水解
难度: 中等查看答案及解析
-
下列检验方法或指定反应的离子(或化学)方程式正确的是( )
A.向NaAlO2溶液中滴入Ca(HCO3)2溶液:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
B.用溴水检验丙烯醛CH2=CHCHO中的碳碳双键:CH2=CHCHO+Br2→CH2Br—CHBr—CHO
C.Na2S溶液吸收少量SO2[已知Ka2(H2SO3)>Ka1(H2S)]:S2-+SO2+H2O=SO32-+H2S↑
D.往二元弱酸亚磷酸(H3PO3)溶液中滴加过量的烧碱溶液:H3PO3+2OH-=HPO32-+2H2O
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.疫苗一般应冷藏存放,以避免蛋白质变性
B.某溶液中加入茚三酮试剂,加热煮沸后溶液出现蓝色,则可判断该溶液含有蛋白质
C.利用NaOH溶液可鉴别植物油和矿物油
D.控制溶液的pH可分离不同的氨基酸是利用氨基酸溶解度的差异
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.c(Fe3+)=1mol/L的溶液中:K+、SCN-、NH4+、Cl-
B.0.1mol/L[Cu(NH3)4]SO4的溶液中:AlO2-、NO3-、Cl-、Na+
C.与Al反应生成H2的溶液中:K+、NO3-、S2O32-、SO42-
D.由水电离的c(H+)=1×10-13mol/L的溶液中:Na+、SO42-、[Ag(NH3)2]+、Cl-
难度: 中等查看答案及解析
-
Y是合成香料、医药、农药及染料的重要中间体,可由X在一定条件下合成:
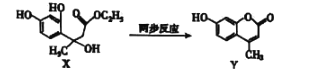
下列说法不正确的是( )
A.Y的分子式为C10H8O3
B.X制取Y过程中的产物之一可使蛋白质变性
C.一定条件下,Y能发生加聚反应和缩聚反应
D.等物质的量的X、Y分别与NaOH溶液反应,最多消耗NaOH的物质的量之比为4:3
难度: 中等查看答案及解析
-
主族元素X、Y、Z、W、U原子序数依次增大,其中X与Y同周期且相邻,Z与U同主族且相邻,Y与W均可形成18个电子的氢化物,且两者可反应生成淡黄色固体,Z是地壳中含量最高的金属元素。下列说法正确的是( )
A.据组成元素推测,X与Z形成的化合物既能溶于强酸又能溶于强碱
B.若Z原子核内含有a个质子,则U原子核内含有a+8个质子
C.Y分别与Z和W形成的化合物中化学键的类型相同
D.对应简单离子半径:r(Y)<r(X)<r(Z)<r(W)
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.298K时,pH=10的氨水稀释100倍,所得溶液的pH=8
B.298K时,pH=9的CH3COONa溶液和pH=5的盐酸等体积混合,溶液显中性
C.HClO与HF的混合溶液中c(H+)=
D.室温下,等pH的盐酸和氯化铵两种溶液,导电能力相同
难度: 中等查看答案及解析
-
以Fe[Fe(CN)6]为代表的新型可充电钠离子电池,其放电工作原理如图所示。下列说法不正确的是( )
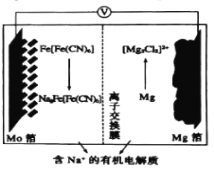
A.放电时,正极反应式:Fe[Fe(CN)6]+2Na++2e-=Na2Fe(Fe(CN)6]
B.充电时,Mg箔接电源的负极
C.充电时,Na+通过离子交换膜从左室移向右室
D.放电时,Mo箔增加4.6g时,Mg箔减少5.95g
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.一定条件下,合成氨反应中有0.5molN2发生反应,则反应中转移电子数为3NA
B.10克环己烷与2-丙醇的混合液中,碳元素的质量分数为72%,则其中所含的氧原子数目为
NA
C.过量铜与含0.4molHNO3的浓硝酸反应,则反应中电子转移数为0.2NA
D.常温常压下有28g单晶硅晶体,则其中所含的Si—Si键数目为2NA
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.Na+和Mg2+核外电子排布相同,核外电子能量也相同
B.已知钾在空气中燃烧的产物含有KO2,KO2中各离子最外层均为8电子稳定结构
C.二甲醚易溶于水,氨基乙酸的熔点较高,主要原因都与氢键有关
D.C60Si60是一种新型的球形分子,经测定结构中包含C60也有Si60,则C60被包裹在Si60中
难度: 中等查看答案及解析
-
在100℃时,容积为5L的真空密闭容器中加入一定量的N2O4,容器内N2O4和NO2的物质的量变化如下表所示:
时间/s
0
2
10
30
60
90
n(N2O4)/mol
0.3
0.25
0.15
0.125
b
0.12
n(NO2)/mol
0
0.1
a
0.35
0.36
0.36
下列说法正确的是( )
A.10s时,以NO2浓度变化表示的该反应速率为0.006mol•L•-1•s-1
B.该温度下反应2(NO2g)⇌N2O4(g)的平衡常数K=0.216
C.35s时容器内压强为反应前的1.6倍
D.其它条件不变,90s后向容器中再加入0.3molNO2建立新平衡时,与原平衡时比较,气体平均相对分子质量增大
难度: 中等查看答案及解析
-
以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制比的过程如图所示。下列叙述正确的是( )

A.H2的标准燃烧热△H<-(△H1+△H2)
B.过程I适当降低反应体系温度,反应更有利
C.过程II中3mo1FeO(s)的总能量高于lmolFe3O4(s)
D.增加铁氧化合物的质量可以显著提高循环制H2的速率
难度: 中等查看答案及解析
-
25℃先将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.lmol/L的KOH溶液以测定氯水的浓度。此过程中溶液pH变化的曲线如图所示。

下列叙述中正确的是( )
A.滴定过程中,当水电离的c(H+)=10-7mol/L时,溶液显中性
B.滴定过程中宜选用酚酞为指示剂,不宜选用甲基橙为指示剂
C.②点的溶液中c(H+)>c(Cl-)>c(HClO)>c(ClO-)
D.③点溶液中c(K+)+c(H+)=c(OH-)+c(Cl-)
难度: 中等查看答案及解析
-
羟氨(NH2OH)可看作氨分子内的一个氢原子被羟基取代的衍生物。下列说法不正确的是( )
A.羟氨的水溶液显碱性,可与盐酸发生反应
B.羟氨既有氧化性又有还原性,受热可生成氨气
C.羟氨分子中N原子、O原子与羟基H原子共直线
D.羟氨易溶于水是由于其与水分子形成分子间氢键
难度: 中等查看答案及解析
-
某固体混合物X,含有Cu、Fe2O3、K2SO4、K2SiO3、K2SO3、KAlO2中的几种。进行如下实验:①X与盐酸作用,产生白色沉淀Y和蓝色强酸性溶液Z;②溶液Z中加入BaCl2溶液,产生白色沉淀M。下列说法正确的是( )
A.白色沉淀Y能分别溶于HF溶液和氨水
B.往溶液Z中加入过量氨水,产生白色沉淀,说明X中一定含有KAlO2
C.X中一定含有Cu、Fe2O3、K2SiO3,可能含有K2SO4
D.沉淀M含有BaSO4、BaSO3中的至少一种
难度: 中等查看答案及解析