-
下列说法中正确的是
A. 因为3O2==2O3是吸热反应,所以臭氧比氧气的化学性质更活泼
B. 需要加热的化学反应一定是吸热反应,不需要加热就能进行的反应一定是放热反应
C. 吸热反应就是反应物的总能量比生成物的总能量高;也可以理解为化学键断裂时吸收的能量比化学键形成时放出的能量多
D. 物质发生化学反应时都伴随着能量变化,伴随能量变化的物质变化一定是化学变化
难度: 简单查看答案及解析
-
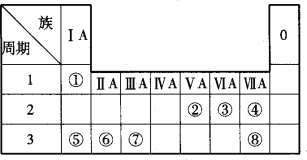
元素在周期表中的位置,反映了元素的原子结构和元素的性质。下列说法正确的( )
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期元素的最高正化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层都达到8电子稳定结构
D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同
难度: 中等查看答案及解析
-
下列反应既属于氧化还原反应,又是吸热反应的是:
A.锌粒与稀硫酸的反应 B.灼热的木炭与CO2的反应
C.甲烷在空气中燃烧的反应 D.Ba(OH)2•8H2O晶体与NH4Cl晶体的反应
难度: 简单查看答案及解析
-
甲、乙是周期表中同一主族的两种元素,若甲的原子序数为X,则乙的原子序数不可能是( )
A.X+2 B.X+4 C.X+8 D.X+18
难度: 简单查看答案及解析
-
下列化合物中,阴离子和阳离子的半径之比最大的是()
A.CsI B.NaF C.LiI D.KCl
难度: 简单查看答案及解析
-
A、B、C、D、E五种短周期元素中,A、B、C位于同一周期相邻位置,A和C的原子序数之比为3:4,A、B、C分别与D形成的化合物分子中都含有10个电子,E的原子结构中从内到外各电子层的电子数之比为1:4:1。下列叙述中正确的是
A.A、B、C分别与D形成的化合物的热稳定性依次减弱
B.A、B两元素的最高价氧化物对应的水化物均为强酸
C.B、C、D三种元素可以形成酸、碱或盐三类物质
D.E的单质在冷的浓硝酸中会发生钝化现象
难度: 简单查看答案及解析
-
银锌纽扣电池,其电池的电池反应式为Zn+ Ag2O+H2O =Zn(OH)2+2Ag。据此判断氧化银是 ( )
A.负极,并被氧化 B.正极,并被还原
C.负极,并被还原 D.正极,并被氧化
难度: 简单查看答案及解析
-
已知断开1 mol H—H键吸收的能量为436 kJ,形成1 mol H—N键放出的能量为391 kJ,根据化学方程式N2+3H2
2NH3,反应完1 mol N2放出的能量为92.4 kJ,则断开1 mol N≡N键需吸收的能量是
A. 431 kJ B. 945.6 kJ C. 649 kJ D. 869 kJ
难度: 简单查看答案及解析
-
19世纪中叶,门捷列夫的突出贡献是( )
A.提出原子分子学说 B.发现元素周期律
C.提出分子学说 D.发现氧气
难度: 简单查看答案及解析
-
下列关于元素周期表和元素周期律的说法错误的是
A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多
B.第二周期元素从Li到F,非金属性逐渐增强
C.因为Na比K容易失去电子,所以Na比K的还原性强
D.O与S为同主族元素,且O比S的非金属性强
难度: 简单查看答案及解析
-
下列电子式正确的是
A.氯化镁
B.过氧化钠
C.氨
D.二氧化碳
难度: 简单查看答案及解析
-
下列说法正确的是
A.氘原子中的质子数和中子数之比为1:1
B.H2O2、H2O中均只含非极性共价键
C.NH4Cl属于离子化合物,不含共价键
D.18g重水(D2O)中含有的电子数为10 NA
难度: 中等查看答案及解析
-
某元素X的气态氢化物的化学式为XH3,则X的最高价氧化物的水化物的化学式为()
A.HXO B.H2XO3 C.HXO3 D.H2XO4
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 离子化合物中不可能有共价键
B. 共价化合物中可能有离子键
C. 凡含有离子键的化合物就一定是离子化合物
D. 只含有共价键的物质一定是共价化合物
难度: 中等查看答案及解析
-
下列各分子中,所有原子都满足最外层8电子稳定结构的是
A.H2O B.PCl3 C.PCl5 D.NO2
难度: 简单查看答案及解析
-
下列说法正确的是:( )
A.Na,Mg,Al还原性依次减弱 B.HCl,PH3,H2S稳定性依次减弱
C.NaOH,KOH,CsOH碱性依次减弱 D.S2-,Cl-,Ca2+半径依次增大
难度: 简单查看答案及解析
-
已知短周期元素的离子:aAm+、bBn+、cCm-、dDn-(m>n)都具有相同的电子层结构,则下列叙述正确的是
A.原子半径:A>B>C>D B.原子序数:d>c>b>a
C.离子半径:C>D>B>A D.单质的还原性:A>B>D>C
难度: 中等查看答案及解析