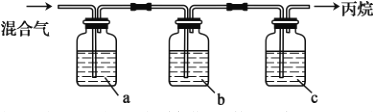
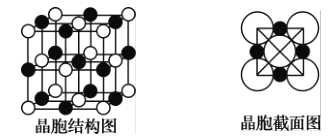
-
中华文明博大精深。下列说法错误的是
A.黏土烧制陶瓷的过程中发生了化学变化
B.商代后期制作的司母戊鼎属于铜合金制品
C.侯氏制碱法中的“碱”指的是纯碱
D.屠呦呦发现的用于治疗疟疾的青蒿素(
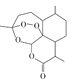 )属于有机高分子化合物
)属于有机高分子化合物难度: 简单查看答案及解析
-
已知NA是阿伏加德罗常数的值。下列说法错误的是
A.反应
中,每生成294 g
g释放的中子数为3NA
B.常温常压下,22.4 L乙烷和丙烯(C3 H6)的混合物中氢原子数目为6NA
C.1 L0.5 mol. L-1'碳酸钠溶液含有的CO32- 数目小于0.5NA
D.0.1 mol H2O2与MnO2充分作用生成O2,转移的电子数为0.1NA
难度: 中等查看答案及解析
-
下列关于有机化合物的说法正确的是
A.糖类、油脂、蛋白质均只含C、H、O三种元素
B.乙烯,乙醇、植物油均能使酸性高锰酸钾溶液褪色
C.2 -苯基丙烯(
)分子中所有原子共平面
D.二环[1,1,0]丁烷(
)的二氯代物有3种(不考虑立体异构)
难度: 中等查看答案及解析
-
由下列实验和现象得出的结论正确的是
选项
实验和现象
结论
A
向某溶液中滴加浓NaOH溶液并加热,将湿润的蓝色石蕊试纸靠近试管口,试纸颜色无明显变化
原溶液中一定无NH4+
B
将少量某无色气体通入澄清石灰水中,出现白色沉淀
该气体一定是CO2
C
向某无色溶液中滴加氯水和CCl4,振荡、静置,下层溶液显紫红色
原无色溶液中一定有I—
D
将稀盐酸滴入硅酸钠溶液中,产生白色胶状沉淀
氯的非金属性强于硅
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
W、R、X、Y均为短周期元素且原子序数依次增大.Y的最高正价和最低负价之和等于0;常温常压下,W和R组成的化合物有多种,其中两种化合物能相互转化,但元素化合价没有变化;这4种元素原子的最外层电子数之和等于R原子的核电荷数的2倍。下列说法正确的是
A.元素的非金属性为R>Y> W
B.原子半径为W>R>X> Y
C.R与其他三种元素均可形成二元共价化合物
D.简单氢化物的热稳定性为R> W> Y
难度: 中等查看答案及解析
-
化石燃料开采、加工过程中会产生剧毒气体硫化氢(H2S),可通过间接电化学法除去,其原理如图所示。下列说法错误的是
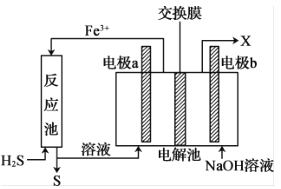
A.反应池中处理硫化氢的反应是H2S+2Fe3+=2Fe2++S↓+2H+
B.电极a为阳极,电极b为阴极
C.若交换膜为质子(H+ )交换膜,则NaOH溶液的浓度逐渐变大
D.若交换膜为阳离子交换膜,b电极区会产生红褐色沉淀
难度: 中等查看答案及解析
-
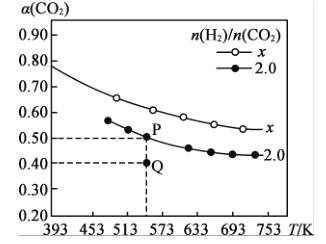
常温下,向20mL0.2mol·L-1H2A溶液中滴加0.2mol.L-1NaOH溶液,溶液中微粒H2A、HA-、A2-的物质的量的变化曲线如图所示。下列说法错误的是
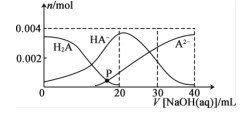
A.当V[NaOH(aq)]=20 mL时.c(OH- )=c(H+ )+c(HA- )+2c(H2A)
B.在P点时,c(Na+ )+c(H+ )=c(OH- )+c(HA- ) +c(A2- )+c(H2A)
C.当V[NaOH(aq)]=30 mL时,2c(Na+ )=3[c(HA- )+c(A2- )+c(H2A)]
D.当V[NaOH(aq)]=40 mL.时.c(Na+ )>c(A2- )>c(OH- )>c(HA- )>c(H2A)>c(H+)
难度: 中等查看答案及解析

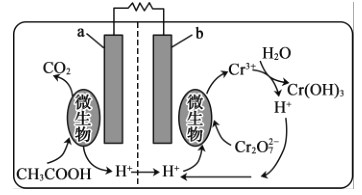

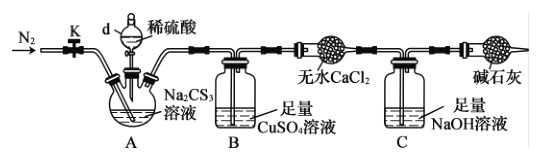

 +R2OH
+R2OH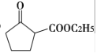 是一种重要的化工中间体。以环已醇(
是一种重要的化工中间体。以环已醇(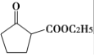 的合成路线:_________________。(已知:RHC=CHR'
的合成路线:_________________。(已知:RHC=CHR'