-
重铬酸钾常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含Cr3+、Fe3+、K+、SO42-等)制备K2Cr2O7的流程如图所示。

已知:i.在酸性条件下,H2O2能将Cr2O72-还原为Cr3+。
ii.相关金属离子形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Fe3+ | Cr3+ |
| 开始沉淀的pH | 1.5 | 4.9 |
| 沉淀完全的pH | 2.8 | 6.8 |
回答下列问题:
(1)滤渣①的主要成分为_________(填化学式)。
(2)"氧化”步骤中发生反应的离子方程式为____________。
(3)“加热"操作的目的是_________。
(4)“酸化"过程中发生的反应为2CrO42- +2H+ Cr2O72-+ H2O (K=4.0×1014L3·mol -3)。已知“酸化”后溶液(pH=1)中c(Cr2O72- )=6. 4×10-3 mol·L-1,则溶液中c(CrO42-)=_______。
Cr2O72-+ H2O (K=4.0×1014L3·mol -3)。已知“酸化”后溶液(pH=1)中c(Cr2O72- )=6. 4×10-3 mol·L-1,则溶液中c(CrO42-)=_______。
(5)可利用微生物电池将镀铬废水中的Cr2O72-催化还原,其工作原理如图所示:
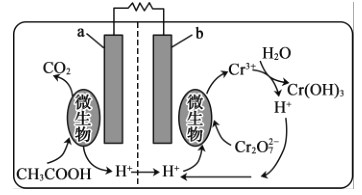
在该电池中,b作______极,a极的电极反应为__________
(6)K2 Cr2O7标准溶液还可用于测定市售硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol -1)的纯度。测定步骤如下:
i.溶液配制:称取1.2400g市售硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在烧杯中溶解,完全溶解后.全部转移至100mL容量瓶中.加蒸馏水至刻度线。
ii.滴定:取0.01000 mol. L-1的K2Cr2 O7标准溶液20. 00 mL,稀硫酸酸化后加入过量KI溶液,发生反应(Cr2O72-被还原成Cr3+ ,I-被氧化成I2)。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32 - =S4O62-+2I-。加入淀粉溶液作为指示剂,继续滴定,当溶液蓝色褪去.即为终点。平行滴定3次,样品溶液的平均用量为25.00mL。
①稀硫酸酸化的K2Cr2O7标准溶液与KI溶液反应的离子方程式为_________
②该市售硫代硫酸钠晶体样品的纯度为_______%(保留1位小数)。
-
重铬酸钾常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含Cr3+、Fe3+、K+、SO42-等)制备K2Cr2O7的流程如下图所示。
已知:I 在酸性条件下,H2O2能将Cr2O72-还原为Cr3+
II相关金属离子形成氢氧化物沉淀的pH范围如下:
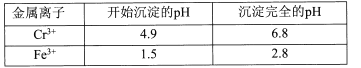
回答下列问题:
(l)滤渣②的主要成分为____(填化学式)。
(2)写出“氧化”步骤中反应的化学方程式____。
(3)“加热”操作的目的是____。
(4)“酸化”过程中发生反应2CrO42-+2H+ Cr2O72-+H2O (K=4×1014L3.mol3)已知,“酸化”后溶液中c(Cr2O72-)=1.6×10-3mol/L则溶液中c(CrO42-)=____
Cr2O72-+H2O (K=4×1014L3.mol3)已知,“酸化”后溶液中c(Cr2O72-)=1.6×10-3mol/L则溶液中c(CrO42-)=____
(5)“结晶”后得到K2Cr2O7(M=294g.mol-1)产品0.5000 g,将其溶解后用稀H2SO4酸化,再用浓度为1.0000 mol.L-l (NH4)2Fe(SO4)2 标准溶液滴定,滴定终点消耗标准溶液的体积为9.00 mL,则产品的纯度为____。[滴定反应为:K2Cr2O7+6(NH4)2Fe(SO4)2+7H2SO4 =K2SO4 +Cr2(SO4)3 +6(NH4)2SO4+3Fe2(SO4)3+7H2O]
(6)在K2Cr2O7存在下,可利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如下图所示。
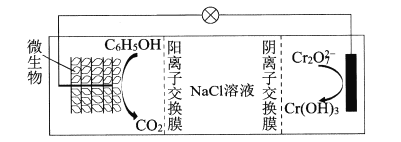
①负极的电极反应式为____;
②一段时间后,中间室中NaCl溶液的浓度____(填“增大”、“减小”或“不变”)。
-
重铬酸钾常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含Cr3+、Fe3+、K+、SO42-等)制备K2Cr2O7的流程如下图所示。
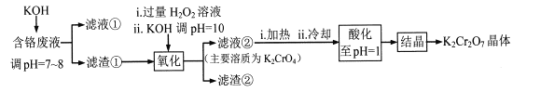
已知:I 在酸性条件下,H2O2能将Cr2O72-还原为Cr3+
II相关金属离子形成氢氧化物沉淀的pH范围如下:
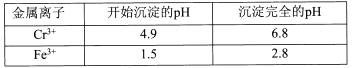
回答下列问题:
(l)滤渣②的主要成分为____(填化学式)。
(2)写出“氧化”步骤中反应的化学方程式____。
(3)“加热”操作的目的是____。
(4)“酸化”过程中发生反应2CrO42-+2H+ Cr2O72-+H2O (K=4×1014L3.mol3)已知,“酸化”后溶液中c(Cr2O72-)=1.6×10-3mol/L则溶液中c(CrO42-)=____
Cr2O72-+H2O (K=4×1014L3.mol3)已知,“酸化”后溶液中c(Cr2O72-)=1.6×10-3mol/L则溶液中c(CrO42-)=____
(5)“结晶”后得到K2Cr2O7(M=294g.mol-1)产品0.5000 g,将其溶解后用稀H2SO4酸化,再用浓度为1.0000 mol.L-l (NH4)2Fe(SO4)2 标准溶液滴定,滴定终点消耗标准溶液的体积为9.00 mL,则产品的纯度为____。[滴定反应为:K2Cr2O7+6(NH4)2Fe(SO4)2+7H2SO4 =K2SO4 +Cr2(SO4)3 +6(NH4)2SO4+3Fe2(SO4)3+7H2O]
(6)在K2Cr2O7存在下,可利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如下图所示。
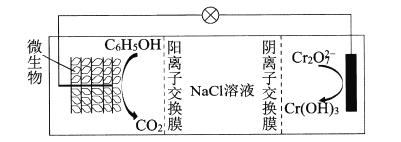
①负极的电极反应式为____;
②一段时间后,中间室中NaCl溶液的浓度____(填“增大”、“减小”或“不变”)。
-
重铬酸钾常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含Cr3+、Fe3+、K+、SO 等)制备K2Cr2O7的流程如图所示。
等)制备K2Cr2O7的流程如图所示。
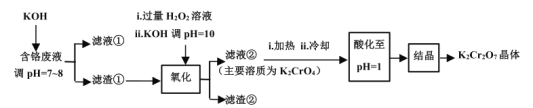
已知:I.在酸性条件下,H2O2能将Cr2O 还原为Cr3+;
还原为Cr3+;
Ⅱ.相关金属离子形成氢氧化物沉淀的pH范围如下:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Cr3+ | 4.9 | 6.8 |
| Fe3+ | 1.5 | 2.8 |
请回答下列问题:
(1)滤渣①的主要成分__。
(2)加入H2O2的作用是(用离子方程式解释)__。
(3)加热的目的是__。
(4)“酸化”过程中发生反应的离子方程式为__;若该反应的平衡常数K=4×1014L3·mol-3,已知:“酸化”后溶液中c(Cr2O )=1.6×10-3mol·L-1,则溶液中c(CrO
)=1.6×10-3mol·L-1,则溶液中c(CrO )=__。
)=__。
(5)“结晶”后得到K2Cr2O7(M=294g·mol-1)产品0.6000g,将其溶解后用稀H2SO4酸化,再用浓度为0.01000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定,滴定反应为:Cr2O +6Fe2++14H+=2Cr3++6Fe3++7H2O,滴定终点消耗标准溶液的体积为900mL,则产品的纯度为__。(计算结果保留四位有效数字)
+6Fe2++14H+=2Cr3++6Fe3++7H2O,滴定终点消耗标准溶液的体积为900mL,则产品的纯度为__。(计算结果保留四位有效数字)
(6)在K2Cr2O7存在下,可利用微生物电化学技术实现含苯酚(C6H5OH)废水的有效处理,其工作原理如图所示。
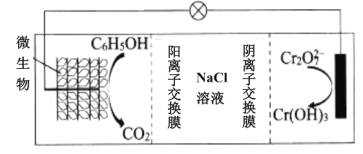
①负极的电极反应式为__;
②一段时间后,中间室中NaCl溶液的浓度__(填“增大”、“减小”或“不变”)。
-
K2Cr2O7是一种橙红色固体,可用于火柴制造、电镀、有机合成等方面。用某酸性废液(主要含Cr3+、还含有少量Fe2+、Fe3+和Al3+等)制备的流程如下:
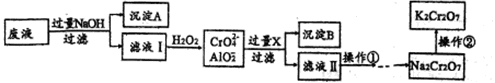
已知:H++CrO2-+H2O Cr(OH)3
Cr(OH)3 Cr3++3OH-
Cr3++3OH-
回答下列问题:
(1)沉淀A的主要成分是_____________(填化学式,下同),流程中的X是__________。
(2)滤液Ⅰ中铬元素的存在形式主要是_____________(填离子符号)。
(3)操作是向滤液中加入稀硫酸调PH至一定范围。在酸性环境中CrO42-转化为Cr2O72-,溶液变为橙红色,该转化的离子方程式是__________;若PH高于此范围,造成的影响是__________。
(4)操作②是向Na2Cr2O7溶液中加入KCl固体后得到K2Cr2O7,说明相同温度下,在水中的溶解度:Na2Cr2O7______________ K2Cr2O7(填“>”、“<”或“=”)。
(5)PbO2可直接将溶液中的Cr3+氧化成Cr2O72-,该反应的离子方程式是__________。
(6)K2Cr2O7可用来测定溶液中Fe2+的含量,还原产物为Cr3+。若1L FeSO4溶液与100mL 0.1mol/L K2Cr2O7溶液恰好完全反应,则c(FeSO4)=___________mol/L。
-
K2Cr2O7是一种橙红色固体,可用于火柴制造、电镀、有机合成等方面。用某酸性废液(主要含Cr3+、还含有少量Fe2+、Fe3+和Al3+等)制备的流程如下:
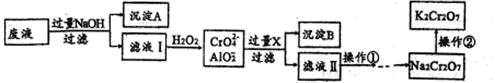
已知:H++CrO2-+H2O Cr(OH)3
Cr(OH)3 Cr3++3OH-
Cr3++3OH-
回答下列问题:
(1)沉淀A的主要成分是_____________(填化学式,下同),流程中的X是__________。
(2)滤液Ⅰ中铬元素的存在形式主要是_____________(填离子符号)。
(3)操作是向滤液中加入稀硫酸调PH至一定范围。在酸性环境中CrO42-转化为Cr2O72-,溶液变为橙红色,该转化的离子方程式是__________;若PH高于此范围,造成的影响是__________。
(4)操作②是向Na2Cr2O7溶液中加入KCl固体后得到K2Cr2O7,说明相同温度下,在水中的溶解度:Na2Cr2O7______________ K2Cr2O7(填“>”、“<”或“=”)。
(5)PbO2可直接将溶液中的Cr3+氧化成Cr2O72-,该反应的离子方程式是__________。
(6)K2Cr2O7可用来测定溶液中Fe2+的含量,还原产物为Cr3+。若1L FeSO4溶液与100mL 0.1mol/L K2Cr2O7溶液恰好完全反应,则c(FeSO4)=___________mol/L。
-
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸。工业用如下流程,从酸性废液(主要含Cu2+、Fe3+、 H+、Cl-)中制备氯化亚铜。

请回答下列问题:
(1)写出步骤①中发生的两个主要反应的离子方程式:_________________________。
(2)步骤②的操作名称是:_____________。
(3)步骤④中所加物质X为:__________。
(4)步骤⑤的操作是:___________________________________________________。
(5)步骤⑥应调节溶液pH呈酸性,且用乙醇洗涤CuCl晶体,目的是:______________。
(6)在CuCl的生成过程中,可以循环利用的物质是______________,理论上_____(填“是”或“否”)需要补充(不考虑调节等消耗);理由是__________________________________。
(7)工业上还可以采用以碳棒为电极电解CuCl2溶液得到CuCl。写出电解CuCl2溶液中的阴极上发生的电极反应 ___________________________________________。
-
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸。工业上采用如下工艺流程,从某酸性废液(主要含Cu2+、Fe3+、 H+、Cl-)中制备氯化亚铜。

请回答下列问题:
(1)写出步骤①中发生的两个主要反应的离子方程式(2分): 。
(2)操作②的名称是: ,步骤④中所加物质X为: 。
(3)步骤⑥应调节溶液pH呈酸性,且用乙醇洗涤CuCl晶体,目的是: 。
-
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸。工业上采用如下工艺流程,从某酸性废液(主要含Cu2+、Fe3+、 H+、Cl-)中制备氯化亚铜。
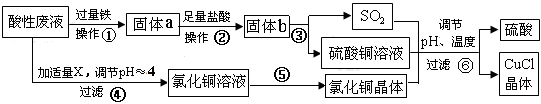
请回答下列问题:(1)写出步骤①中发生的两个主要反应的离子方程式: 。
(2)步骤②的操作名称是: 。
(3)步骤④中所加物质X为: 。
(4)步骤⑤的操作是: 。
(5)步骤⑥应调节溶液pH呈酸性,且用乙醇洗涤CuCl晶体,目的是: 。
(6)在CuCl的生成过程中,可以循环利用的物质是__________,理论上_______(填“是”或“否”)需要补充(不考虑调节等消耗);理由是 。
(7)工业上还可以采用以碳棒为电极电解CuCl2溶液得到CuCl。写出电解CuCl2溶液中的阴极上发生的电极反应 。
-
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水不溶于乙醇及稀硫酸。工业上采用如下工艺流程,从菜酿性废液( 主要會Cu2+、Fe3+、H+、Cl-)中 制备氯化亚 铜。

(1)操作①②的名称是_________________。
(2)写出加入过量X发生化合反应的离子方程式:____________________。
(3)生成蚀刻液的离子方程式是式:____________________。
(5)写出生成CuCl的化学方程式式:____________________。298K 时, Ksp.(CuCl)=1.2×10-6,要使Cu+沉淀完全,则容液中(Cl- )至少为__________________。洗涤CuCl晶体所用的试剂为____(填序号)。
A.饱和Na2CO3溶液 B.NaOH 溶液 C.无水乙醇 D.四氯化碳
(5)准确称取所制得的0.250gCuCl样品置于一定量的0.5mol/LFeCl3溶液中,待样品完全溶解后,加水20mL,用0.10 0mol/L 的Ce(SO4)2溶液滴定到终点,消耗22. 60mLCe(SO4)2溶液。已知有关反应的离子方程式为Fe3++CuCl=Fe2++ Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+;国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.50%。试通过计算说明上述样品是否符合国家标准。_____________________

Cr2O72-+ H2O (K=4.0×1014L3·mol -3)。已知“酸化”后溶液(pH=1)中c(Cr2O72- )=6. 4×10-3 mol·L-1,则溶液中c(CrO42-)=_______。














