-
氮、铜及其化合物以及乙醇、氯化钠的用途广泛。回答下列问题:
(1)基态氮原子中含有______种运动状态不同的电子,与N3-含有相同电子数的四原子分子是_______(写化学式),其立体构型是________。
(2)C、N、O、F四种元素的第一电离能由小到大的顺序为_____。
(3)Cu+价层电子的轨道表达式(电子排布图)为______。CuO在高温下能分解生成Cu2O,其原因是_______。
(4)在加热和Cu的催化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醛分子中碳原子的杂化方式是____,乙醛分子中H一C—O的键角____ (填“大于”等于”或“小于”)乙醇分子中的H—C—O的键角。
(5)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代后有两种不同的结构,其中[Cu( H2O)2(Cl)2]是非极性分子的结构式为________。
(6)如图所示为NaCl晶体的晶胞结构图和晶胞截面图(截面图中的大球为Cl-,小球为Na+);
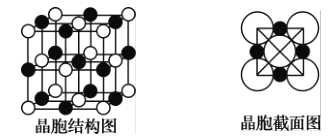
①晶胞中距离1个Na+最近的Cl-有_____个 ,这些C1-围成的图形是___________。
②若晶体密度为ρg●cm-3,阿伏加德罗常数的值用NA表示,则Na+的离子半径为_______pm(列出计算表达式)。
-
铜及其化合物的用途非常广泛,回答下列问题:
(1)基态铜原子有种不同运动状态的电子,二价铜离子的电子排布式为________。
(2)铜能与类卤素(CN)2反应生成Cu(CN)2 1mol(CN)2分子中含有π键的数目为___________。
(3)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写),结构如图所示,

则Cu2+的配位数为_________,该配离子中所含的非金属元素的电负性由大到小的顺序是________;乙二胺分子中氮原子轨道的杂化类型为______,乙二胺和三甲胺[N(CH3)3]均属于胺,但相对分子质量相近,但乙二胺比三甲胺的沸点高的多,原因是__________。
(4)铜晶体中铜原子的堆积方式为面心立方堆积,每个铜原子周围距离最近的铜原子数目为________。
(5)某M原子的外围电子排布是为3s23p5,铜与M形成化合物的晶胞如图所示(黑球代表铜原子)。
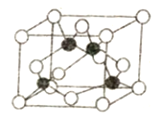
①已知铜和M的电负性分别为1.9和3.0,则铜与M形成的该种化合物属于________ (填“离子”或“共价”)化合物。
②已知该晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为______pm(只写计算式)。
-
铝及其化合物在生产、生中用途广泛。回答下列问题:
(1)在一定条件下,金属Al和Cu可以形成金属互化物Cu9Al4,基态Al原子核外电子有_____种不同的运动状态。基态Cu原子的核外电子排布式为______________。
(2)Na、Mg、Al三种元素中,第一电离能最大的是_______,原因是_____________。
(3)Al3+与Cl-易形成配位离子[AlCl4]-,其中Al与Cl之间形成的化学键类型为______(填“离子键”“极性键”或“非极性键”),Al原子的配位数为______,Al原子的杂化方式为_______,[AlCl4]-的空间构型为_____,试写出一种[AlCl4]-互为等电子体的微粒符号:____________。
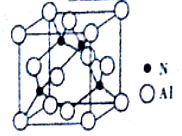
(4)AlN的晶体结构与金刚石相似,晶胞结构如图所示。晶胞中含有_____个铝原子,若Al与N原子最近距离为apm,则该晶体的密度为______g/cm3。(阿伏加德罗常数用NA表示)
-
过渡元素参与组成的新型材料有着广泛的用途,回答下列问题。
(1)基态铁原子核外共有________种不同空间运动状态的电子。铁、钴、镍基态原子中,核外未成对电子数最少的原子价层电子轨道表示式(电子排布图)为________。
(2)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和74pm,则熔点NiO________FeO(填“>”“<”或“=”),原因是________。
(3)Cr的一种配合物结构如图所示:
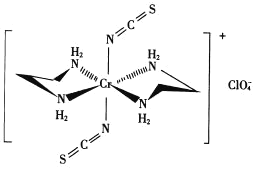
①阴离子 的空间构型为________形。
的空间构型为________形。
②配离子中,中心离子的配位数为_______,N与中心原子形成的化学键称为_______键。
③配体H2NCH2CH2NH2(乙二胺)中碳原子的杂化方式是________,分子中三种元素电负性从大到小的顺序为________。
(4)一种新型材料的晶胞结构如图1所示,图2是晶胞中Sm和As原子的投影位置。
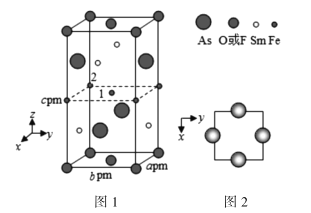
图1中F和O共同占据晶胞的上下底面位置,若两者的比例依次用x和1−x代表,则该化合物的化学式表示为________,晶体密度ρ=________g·cm−3(用含x的表达式表示,设阿伏加德罗常数的值为NA)。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标( ),则原子2的坐标为________。
),则原子2的坐标为________。
-
硼及其化合物在工业上有重要的用途,回答下列问题:
(1)基态硼原子有___个不同运动状态的电子,其电子云轮廓图为哑铃形的电子有___个,基态硼原子最高能级的电子排布式为___。
(2)BF3能与多种物质化合。
①BF3的空间结构为___,其分子的极性为___。
②气态BF3与无水乙醚可化合生成 ,该产物中硼原子的杂化类型为___,该产物熔点为-58℃,沸点为126℃~129℃,据此判断该产物的晶体类型为___。
,该产物中硼原子的杂化类型为___,该产物熔点为-58℃,沸点为126℃~129℃,据此判断该产物的晶体类型为___。
③BF3与NH3可形成“H3N-BF3”分子,其原因是___。
(3)硼原子和磷原子能形成原子晶体磷化硼,其密度为ρg/cm3,晶胞如图所示:
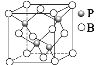
磷化硼的化学式为:___。
硼原子的配位数为:___。
③其晶胞参数a=___pm(B的相对原子质量为10.8,P的相对原子质量为31,阿伏加德罗常数值用NA表示。
-
氮元素十分重要,其单质及其化合物在科研、生产领域有着十分广泛的用途。
(1)氮元素核外电子排布式为: ,原子核外共有 种不同能级的电子,氮原子核外电子云有 种不同的伸展方向,有 种不同运动状态的电子。
(2)最新“人工固氮”的研究报道:常温常压、光照条件下,N2在催化剂表面与水发生反应:
2N2 (g)+6H2O (l) 4NH3 (g)+3O2 (g) - Q ,如果反应的平衡常数K值变大,该反应 (选填编号)。
4NH3 (g)+3O2 (g) - Q ,如果反应的平衡常数K值变大,该反应 (选填编号)。
A.一定向正反应方向移动
B.在平衡移动时正反应速率先增大后减小
C.一定向逆反应方向移动
D.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中进行,当反应达到平衡后,下列判断错误的是
A.容器中气体的平均分子量不随时间而变化 B.通入大量稀有气体能提高反应的速率
C.容器中气体的密度不随时间而变化 D. (N2)/
(N2)/  (O2)=2:3
(O2)=2:3
(4)高氯酸铵作为火箭燃料的重要氧载体。高氯酸铵在高压、450℃的条件下迅速分解,反应的化学方程式4NH4ClO4 6H2O↑+ 2N2↑+ 4HCl↑+ 5O2↑,其中氧化产物与还原产物的物质的量之比是 ,每分解1mol高氯酸铵,转移的电子数目是 。
6H2O↑+ 2N2↑+ 4HCl↑+ 5O2↑,其中氧化产物与还原产物的物质的量之比是 ,每分解1mol高氯酸铵,转移的电子数目是 。
-
碳是形成化合物种类最多的元素,其单质及化合物有独特的性质和用途。请回答下列问题。
(1)碳原子核外电子有_____种不同的运动状态。碳原子的价电子在形成sp3杂化后,其轨道表达式为_____。
(2)写出一种CO32-的等电子体微粒的化学式_______,其空间构型为_______。
(3)有机物M(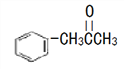 )在一定条件下生成N(
)在一定条件下生成N(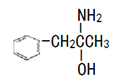 )。
)。
①沸点:M_____N (填“大于”或“小于”)。
②M中碳原子杂化类型为_____,不同杂化类型的碳原子数之比为_____。
③有机物N中除氢原子之外的其他原子的第一电离能由大到小的顺序为_____。
(4)已知CaCO3的热分解温度为900℃,SrCO3的热分解温度为1172℃,试从原子结构的角度解释CaCO3的热分解温度低于SrCO3的原因_____________。
(5)碳的一种同素异形体C60,又名足球烯,是一种高度堆成的球碳分子。立方烷(分子式:C8H8, )是比C60约早20年合成出的一种对称性烃类分子,而如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如下图所示,立方烷分子填充在原C60晶体的分子间空隙中。则该复合型分子晶体的组成用二者的分子式可表示为______________。
)是比C60约早20年合成出的一种对称性烃类分子,而如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如下图所示,立方烷分子填充在原C60晶体的分子间空隙中。则该复合型分子晶体的组成用二者的分子式可表示为______________。

(6)石墨是碳的一种同素异形体,它的一种晶胞结构和部分晶胞参数如下图:
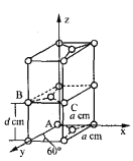
①原子坐标参数描述的是晶胞内原子间的相对位置。石墨晶胞中碳原子A、B的坐标参数分别为:A(0,0,0)、B(0,1,1/2)。则C原子的坐标参数为_______________。
②晶胞参数用以描述晶胞的大小和形状。已知石墨晶胞底边长为acm ,层间距为dcm,阿伏加德罗常数的值为NA,则石墨的密度为_____g·cm-3(写出表达式即可)。
-
碳是形成化合物种类最多的元素,其单质及化合物有独特的性质和用途。请回答下列问题。
(1)碳原子核外电子有_____种不同的运动状态。碳原子的价电子在形成sp3杂化后,其轨道表达式为_____。
(2)写出一种CO32-的等电子体微粒的化学式_______,其空问构型为_______。
(3)有机物M( )在一定条件下生成N(
)在一定条件下生成N(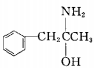 )。
)。
①沸点:M_____N (填“大于”或“小于”)。
②M中碳原子杂化类型为_____,不同杂化类型的碳原子数之比为_____。
③有机物N中除氢原子之外的其他原子的第一电离能由大到小的顺序为_____。
(4)已知CaCO3的热分解温度为900℃,SrCO3的热分解温度为1172℃,试从原子结构的角度解释CaCO3的热分解翻度低于SrCO3的原因_____________。
(5)石墨是碳的一种同素异形体,它的一种晶胞结构和部分晶胞参数如下图:

①原子坐标参数描述的是晶胞内原子间的相对位置。石墨晶胞中碳原子A、B的坐标参数分别为:A(0,0,0)、B(0,1,1/2)。则C原子的坐标参数为_______________。
②晶胞参数用以描述晶胞的大小和形状。已知石墨晶胞底边长为am ,层间距为dcm,阿伏加德罗常数的值为NA,则石墨的密度为_____g·cm-3(写出表达式即可)。
-
铁及其化合物在生产、生活中存在广泛用途,完成下列填空。
(1)如图所示为铁元素在周期表中的信息,方格中“55.85”的意义为: 。铁原子核外有 种运动状态不同的电子。

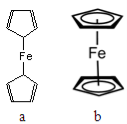
(2)二茂铁[Fe(C5H5)2]是一种有机金属化合物,熔点172℃,沸点249℃,易升华,难溶于水易溶于有机溶剂。二茂铁属于 晶体;测定表明二茂铁中所有氢原子的化学环境都相同,则二茂铁的结构应为图中的 (选填“a”或“b”)。
(3)绿矾(FeSO4·7H2O)可用于治疗缺铁性贫血,其水溶液露置于空气中会变质,
写出发生变质反应的离子方程式 。
(4)无水FeCl3是水处理剂,遇潮湿空气即产生白雾,易吸收空气中的水分成为结晶氯化铁(FeCl3·6H2O)。制备无水FeCl3的试剂是 。
(5)高铁酸盐也是常用的水处理剂。高铁酸钠(Na2FeO4)可用如下反应制备:
2FeSO4 + 6Na2O2 → 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,若生成2mol Na2FeO4,则反应中电子转移的物质的量为 mol。
(6)高铁酸盐可将水体中的Mn2+氧化为MnO2进行除去,若氧化含 Mn2+ 1mg的水体样本,需要1.2 mg/L高铁酸钾 L。
-
钙及其化合物在工业上、建筑工程上和医药上用途很大。回答下列问题
(1)基态Ca原子M能层有_____个运动状态不同的电子,Ca的第一电离能__________(填“大于”或“小于”)Ga。
(2)Mn和Ca属于同一周期,且核外最外层电子构型相同,但金属Mn的熔点沸点等都比金属Ca高,原因是____________________。
(3)氯气与熟石灰反应制漂白粉时会生成副产物Ca(ClO3)2,Ca(ClO3)2中的阴离子空间构型是__________、中心原子的杂化形式为___________。
(4)碳酸盐的热分解示意图如图所示
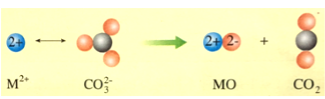
热分解温度:CaCO3_______ (填“高于”或“低于”)SrCO3,原因是_____________________________。从价键轨道看,CO2分子内的化学键类型有__________。
(5)萤石是唯一一种可以提炼大量氟元素的矿物,晶胞如图所示。Ca2+的配位数为__________,萤石的一个晶胞的离子数为__________,已知晶胞参数为0.545nm,阿伏加德罗常数的值为NA,则萤石的密度为__________g·cm-3(列出计算式)。







 )在一定条件下生成N(
)在一定条件下生成N( )。
)。

 )在一定条件下生成N(
)在一定条件下生成N( )。
)。


