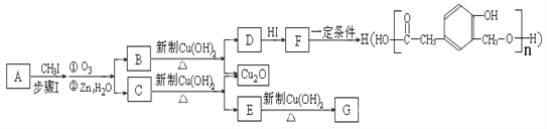
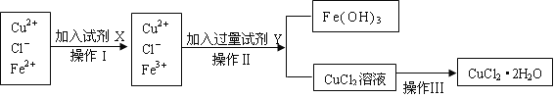
-
下列说法正确的是 ( )
A.增大压强,活化分子数增加,化学反应速率一定增大
B.升高温度,活化分子百分数增加,化学反应速率一定增大
C.活化分子间所发生的分子间的碰撞为有效碰撞
D.加入反应物,使活化分子百分数增加,化学反应速率增大
难度: 中等查看答案及解析
-
下列物质混合时能发生反应,但无明显现象的是( )
A.二氧化碳与苯酚钠溶液 B.乙酸钠溶液与硫酸氢钠溶液
C.苯酚溶液与氯化铁溶液 D.氢氧化铜悬浊液与甲酸溶液
难度: 中等查看答案及解析
-
1个C原子的单键氢化物分子是CH4,2个C原子的单键氢化物分子则为C2H6,以下各对分子间不存在类似关系的是( )
A.NH3与N2H4 B.H2O与H2O2 C.SF6与S2F10 D.SCl4与S2Cl2
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.油脂和蛋白质均属于高分子化合物
B.二氧化硅是太阳能电池的主要材料
C.Na,C,S都能直接与氧气反应,生成两种相应的氧化物
D.蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体
难度: 中等查看答案及解析
-
某液态烃,它不跟溴水反应,但能使KMnO4酸性溶液褪色。将其0.5mol完全燃烧生成的CO2 通入含5mol NaOH的溶液中,所得碳酸钠和碳酸氢钠的物质的量之比为1:3。则该烃可能是
A.1-丁烯 B.1,3-二甲苯
C.甲苯 D.2-甲基-3-乙基-2-戊烯
难度: 中等查看答案及解析
-
二十世纪化学合成技术的发展对人类健康和生活质量的提高作出了巨大贡献。下列各组物质全部由化学合成得到的是( )
A. 玻璃 纤维素 青霉素 B. 尿素 食盐 聚乙烯
C. 涤纶 洗衣粉 阿司匹林 D. 石英 橡胶 磷化铟
难度: 简单查看答案及解析
-
下列有关有机物分离提纯的方法正确的是( )
A.溴乙烷中混有溴单质,用NaOH溶液和水溶液,反复洗涤,再分液
B.肥皂中混有甘油,加入NaCl粉末,盐析
C.乙酸乙酯中混有乙酸,加入饱和Na2CO3溶液,充分反应后,再蒸馏
D.乙醛中混有乙烯,可通过溴水,即可除去乙烯
难度: 简单查看答案及解析
-
等质量的下列烷烃,完全燃烧消耗氧气最多的是( )
A.CH4 B.C2H6 C.C3H8 D.C6H14
难度: 简单查看答案及解析
-
Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为2Li++FeS+2e-=Li2S+Fe。有关该电池的下列说法中正确的是( )
A.Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价
B.该电池的电池反应式为2Li+FeS=Li2S+Fe
C.负极的电极反应式为Al-3e-=Al3+
D.能用硫酸作为电解质溶液
难度: 中等查看答案及解析
-
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是

A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c(SO42-)减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
难度: 困难查看答案及解析
-
已知常温下KHSO3溶液的pH<7,且等浓度的
的电离程度大于
的水解程度。等物质的量的KHSO3、K2SO3、K2SO4溶于足量水形成的溶液中,有关粒子之间的关系正确的是( )
A.c(
)>c(
)>c(
) >c(H2SO3)
B.c(K+)>c(
)>c(
)>c(
)>c(H+)>c(OH-)
C.c(K+)=c(
)+2c(
)+2c(
)
D.c(K+)+c(H+)=c(
)+c(
)+c(
)+c(OH-)
难度: 中等查看答案及解析
-
难溶盐CaCO3在下列溶液中溶解度最大的是( )
A.0.1 mol·L-1CH3COOH B.0.10 mol·L-1CaSO4 C.纯水 D.1.0 mol·L-1Na2CO3
难度: 中等查看答案及解析
-
已知下列热化学方程式:
① Fe2O3(s) + 3CO(g) = 2Fe(s) + 3CO2(g) △H= -25kJ·mol-1
② 3Fe2O3(s) + CO(g) = 2Fe3O4(s) + CO2(g) △H= - 47kJ·mol-1
则下列关于Fe3O4(s)被CO还原成Fe(s)和CO2的热化学方程式的书写中正确的是
A.Fe3O4 + 4CO = 3Fe + 4CO2△H= -14kJ·mol-1
B.Fe3O4(s) + 4CO(g) = 3Fe(s) + 4CO2(g)△H= -22kJ·mol-1
C.Fe3O4(s) + 4CO(g) = 3Fe(s) + 4CO2(g)△H= +14kJ·mol-1
D.Fe3O4(s) + 4CO(g) = 3Fe(s) + 4CO2(g)△H= -14kJ·mol-1
难度: 中等查看答案及解析
-
图中的曲线是表示其他条件一定时,2NO(g)+O2(g)⇌2NO2(g) ΔH<0反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v正>v逆的点是( )

A.a点
B.b点
C.c点
D.d点
难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理解释的是( )
A.氨水应密闭保存,置低温处
B.将铜粉和锌粉混合后放入稀硫酸中,产生气体的速率比不加铜粉快
C.黄绿色的氯水光照后颜色变浅
D.常温下,用水稀释烧碱溶液pH会降低
难度: 中等查看答案及解析
-
将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g)
2HBr(g)
H<0;平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是( )
A.a>b B.a=b C.a<b D.无法确定
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.10 L 0.05mol·L-1Ba(OH)2溶液与10 L 0.05mol·L-1H2SO4反应时的反应热是中和热
B.由2H2(g)+O2(g)=2H2O(l) ΔH =-571.6 kJ·mol-1知,该反应的反应热为571.6 kJ·mol-1
C.由2H2(l)+O2(l)=2H2O(g) ΔH =-482.6 kJ·mol-1知,H2的燃烧热为482.6 kJ·mol-1
D.由C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH =-2221.5 kJ·mol-1知,气体C3H8的燃烧热为2221.5 kJ·mol-1
难度: 中等查看答案及解析
-
下列方法对2SO2(g)+O2(g)
2SO3(g)的反应速率没有影响的是
A.加入SO3 B.容积不变,充入N2
C.压强不变,充入N2 D.降低温度
难度: 简单查看答案及解析
-
已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-Q1②H2(g)+
O2(g)=H2O(g) ΔH2=-Q2③H2(g)+
O2(g)=H2O(l) ΔH3=-Q3。常温下取体积比为4∶1的甲烷和氢气共11.2 L(已折合成标准状况)经完全燃烧恢复到常温,放出的热量为( )
A.0.4Q1+0.05Q2 B.0.4Q1+0.1Q2 C.0.4Q1+0.05Q3 D.0.4Q1+0.1Q3
难度: 中等查看答案及解析
-
铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如图所示。下列说法不正确的是
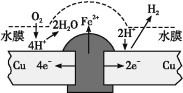
A.因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀
B.若水膜中溶解了SO2,则铁铆钉腐蚀的速率变小
C.铜极上的反应是2H++2e− =H2↑、O2+4e−+4H+=2H2O
D.在金属表面涂一层油脂,能防止铁铆钉被腐蚀
难度: 中等查看答案及解析
-
某烯烃与氢气加成后得到2,2-二甲基丁烷,则该烯烃的名称是( )
A. 3,3-二甲基-1-丁烯 B. 2,2-二甲基-2-丁烯
C. 2,2-二甲基-1-丁烯 D. 2,2-二甲基-3-丁烯
难度: 简单查看答案及解析
-
下面是生产生活中的常见有机物的分子式、结构式、结构简式或名称有关说法正确的是
①
②
③
④
⑤CH3CH2OH
⑥C6H12O6⑦CH3COOH ⑧硬脂酸甘油酯 ⑨蛋白质 ⑩聚乙烯
A.能跟溴的四氯化碳溶液发生加成反应并使之褪色的有①②④⑩
B.投入钠能产生H2的是⑤⑦⑧⑨
C.属于高分子材料的是⑧⑨⑩
D.含碳量最高、有毒、常温下为液体且点燃时有浓烟的是①
难度: 中等查看答案及解析
-
某酯C6H12O2经水解后得到相同碳原子数的羧酸和醇,再把醇氧化得到丙酮(
),该酯是( )
A.C3H7COOC2H5 B.C2H5COOCH(CH3)2
C.C2H5COOCH2CH2CH3 D.
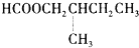
难度: 中等查看答案及解析
-
烷烃是由碳元素和氢元素组成的一类有机物,通常把烷烃泛称“某烷”,“某”是指烷烃中碳原子的数目.碳原子数在十以内的烷烃,依次用“天干”(甲乙丙丁戊己庚辛壬癸)来代表其碳原子数.部分有机物分子组成和结构的表示方法如下:
名称
甲烷
乙烷
丙烷
丁烷
戊烷
化学式
CH4
C2H6
C3H8
C4H10
C5H12
结构式
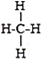
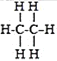
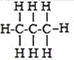


据此推测己烷的化学式为( )
A.C6H12 B.C6H24 C.C6H18 D.C6H14
难度: 简单查看答案及解析
-
M的名称是乙烯雌酚,它是一种激素类药物,结构简式如下。下列叙述不正确的是

A.M属于芳香族化合物
B.M可与NaOH溶液或NaHCO3溶液发生反应
C.1molM最多能与7molH2发生加成反应
D.1molM与饱和溴水混合,最多消耗5molBr2
难度: 中等查看答案及解析
-
“地沟油”是用饭店的泔水及垃圾猪肉等加工而成的“食用油”。下列有关说法中正确的是( )
A.“地沟油”的主要成分是蛋白质,还含有较多的微量元素
B.“地沟油”外观与普通食用油一样,经过处理的“地沟油”具有固定的熔沸点
C.“地沟油”在加入消泡剂后,消除了其对人体健康的影响
D.“地沟油”可用于生产生物柴油
难度: 简单查看答案及解析

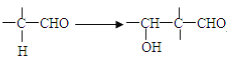
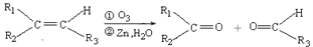 (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)