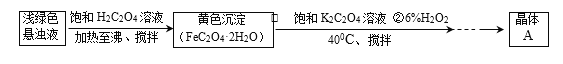
-
2020年1月10日,国家自然科学奖一等奖授予中国科学院院士周其林教授领导团队历时20年科研攻关完成的重要科研成果“高效手性螺环催化剂的发现”。关于催化剂说法正确的是
A.可以改变反应速率 B.可以改变反应热(ΔH)
C.可以改变反应转化率 D.可以改变反应平衡常数
难度: 简单查看答案及解析
-
高温炼铜的反应之一为:2CuFeS2 + O2=Cu2S + 2FeS + SO2。下列有关化学用语的说法正确的是
A.铜原子的核外电子排布式为[Ar]3d94s2
B.SO2分子空间构型为直线型
C.S2—的结构示意图
D.质量数为18的氧原子可表示为:188O
难度: 中等查看答案及解析
-
常温下,下列离子在指定溶液中一定能大量共存的是
A.0.1mol·L-1NaHCO3溶液:K+、Al3+、NO3-、SO42-
B.
10-12的溶液中:Na+、K+、ClO-、CO32-
C.能使红色石蕊试纸变蓝的溶液:NH4+、K+、Cl-、NO3-
D.水电离的c(H+)=10—11mol·L-1的溶液中:Na+、Ca2+、HCO3-、Cl-
难度: 中等查看答案及解析
-
常温下,下列溶液均为
,有关叙述正确的是( )
A.碳酸氢钠溶液中
B.碳酸钠溶液比碳酸氢钠溶液的pH小
C.碳酸钠溶液中
D.碳酸钠溶液中滴加盐酸至pH=7,所得溶液的溶质只有NaCl
难度: 中等查看答案及解析
-
氢能被视为21世纪最具发展潜力的清洁能源。根据下列图示有关说法正确的是
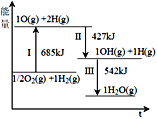
A.断开非极性键和生成极性键的能量相同
B.反应II比反应III生成的O-H键更牢固
C.1/2O2(g) +H2(g) → OH(g) + H(g) ΔH1>0
D.H2O(g)→ 1/2O2(g) +H2(g) ΔH2<0
难度: 中等查看答案及解析
-
四种短周期主族元素W、X、Y、Z,W元素的原子在短周期中原子半径最大,X元素原子的L电子层的p能级上有一个空轨道,Y元素原子L电子层的P能级上只有一对成对电子,Y和Z在周期表中处于同一主族。下列有关叙述不正确的是
A.原子半径:W>X>Y
B.XY2是极性键构成的非极性分子
C.W、Y、Z三种元素组成的化合物多于2种
D.化合物W2Y2中的阴阳离子个数比为1﹕1
难度: 中等查看答案及解析
-
用下列实验装置进行相应实验,能达到实验目的的是

A.用图1装置蒸发CuCl2溶液获得无水CuCl2
B.用图2装置可证明非金属强弱:Cl>C>Si
C.用图3装置制备少量白色的Fe(OH)2沉淀
D.用图4装置进行已知浓度的NaOH溶液测定未知浓度的盐酸
难度: 中等查看答案及解析
-
以下反应可表示获得乙醇并用作汽车燃料的过程,下列有关说法正确的是
①6CO2(g)+6H2O(l)=C6H12O6(s)+6O2(g) ΔH1
②C6H12O6(s)=2C2H5OH(l)+2CO2(g) ΔH2
③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH3
A.2ΔH3=-ΔH1-ΔH2
B.在不同油耗汽车中发生反应③,ΔH3会不同
C.植物的光合作用通过反应①将热能转化为化学能
D.反应④C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH4,则ΔH3>ΔH4
难度: 中等查看答案及解析
-
锌-空气电池(原理如图)适宜用作城市电动车的动力电源。该电池放电时Zn转化为ZnO。该电池工作时下列说法正确的是
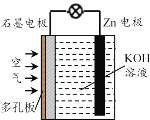
A.该电池放电时OH—向石墨电极移动
B.放电时氧气在石墨电极上发生还原反应
C.该电池在充电时Zn电极应与电源正极相连
D.该电池的负极反应为:Zn + H2O-2e—=ZnO + 2H+
难度: 中等查看答案及解析
-
为验证次氯酸光照分解的产物,某同学采用三种传感器分别测得氯水光照过程中pH、Cl-浓度、
体积分数的变化,实验数据如图所示,下列叙述错误的是( )
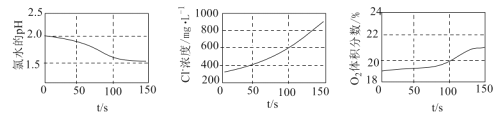
A.从0 s到150 s,溶液pH降低的原因是
的电离程度增大
B.从0 s到150 s,溶液中
增加到起始浓度的
倍
C.从50 s到150 s,
的平均生成速率约为
D.
光照分解的产物有
、
难度: 中等查看答案及解析
-
下列说法正确的是
A.电镀时通常把待镀金属制品作阳极,镀层金属作阴极
B.298K时,2H2S(g) + SO2(g)=3S(s) + 2H2O(l)能自发进行,则其ΔH<0
C.3molH2 和1molN2混合反应生成NH3,转移电子数为6×6.02×1023
D.常温下,pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合后的溶液呈碱性
难度: 中等查看答案及解析
-
室温下进行下列实验,根据实验操作和现象所得出的结论正确的是
选项
实验操作和现象
结论
A
用Zn和稀硫酸反应制取氢气,向反应液中滴入几滴CuSO4溶液,产生气泡的速率明显加快
Cu2+是反应的催化剂
B
向滴有酚酞的1mL0.1mol·L-1Na2CO3溶液中加水稀释至10mL,红色变浅
加水稀释时,CO32—的水解平衡向逆反应方向移动
C
向5 mL 0.1 mol·L-1 KI溶液中加入0.1 mol·L-1 FeCl3溶液1 mL,振荡,用苯萃取2~3次后,取下层溶液滴加5滴KSCN溶液,出现血红色
反应2Fe3++2I-=2Fe2++I2是有一定限度的
D
向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸有气泡产生
Ksp(BaCO3)<Ksp(BaSO4)
A.A B.B C.C D.D
难度: 中等查看答案及解析