-
以活性炭为催化剂,可以将工业废气中的SO2催化氧化变为硫酸,进而制得各种硫酸盐,如硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]等。
(1)研究表明,SO2在活性炭上催化氧化的反应机理可以表示为(*标记的为吸附状态)
Ⅰ.二氧化硫的吸附:SO2(g) SO2* ΔH1=a kJ·mol-1
SO2* ΔH1=a kJ·mol-1
Ⅱ.氧气的吸附:O2(g) 2O* ΔH2=b kJ·mol-1
2O* ΔH2=b kJ·mol-1
Ⅲ.三氧化硫的氧化:SO2*+O*=SO3* ΔH3=c kJ·mol-1
Ⅳ.三氧化硫的脱附:SO3* SO3(g) ΔH4=d kJ·mol-1
SO3(g) ΔH4=d kJ·mol-1
根据上述反应机理,写出SO2在活性炭上催化氧化的热化学方程式____。
(2)以硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为原料通过下列流程可以制备晶体A。
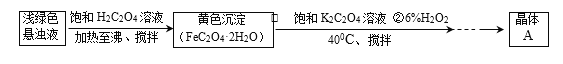
①已知25 ℃时,[Fe(C2O4)3]3-(aq)+SCN-(aq) [Fe(SCN)]2+(aq)+3C2O42-(aq),K=10-16。某研究小组同学欲检验晶体A中含有三价铁,取少量晶体放入试管中,用蒸馏水充分溶解,向试管中滴入几滴0.1 mol·L-1KSCN溶液。请判断上述实验方案是否可行并说明理由:____。
[Fe(SCN)]2+(aq)+3C2O42-(aq),K=10-16。某研究小组同学欲检验晶体A中含有三价铁,取少量晶体放入试管中,用蒸馏水充分溶解,向试管中滴入几滴0.1 mol·L-1KSCN溶液。请判断上述实验方案是否可行并说明理由:____。
②某研究小组通过如下实验步骤测定晶体A的化学式:
步骤1:准确称取A样品4.910 0 g,干燥脱水至恒重,残留物质量为4.370 0 g;
步骤2:准确称取A样品4.910 0 g置于锥形瓶中,加入足量的3.000 mol·L-1 H2SO4溶液和适量蒸馏水,用0.500 0 mol·L-1 KMnO4溶液滴定,当MnO4-恰好完全被还原为Mn2+时,消耗KMnO4溶液的体积为24.00 mL;(C2O42-+MnO4-+H+→CO2↑+Mn2++H2O)
步骤3:将步骤1所得固体溶于水,加入铁粉0.280 0 g,恰好完全反应。
通过计算确定晶体A的化学式(写出计算过程)。_____________
-
二氧化硫的催化氧化反应:2SO2(g)+O2(g) 2SO3(g)是工业制硫酸的重要反应之一。下列说法错误的是
2SO3(g)是工业制硫酸的重要反应之一。下列说法错误的是
A. 煅烧硫铁矿(主要成分FeS2)可获得SO2,将矿石粉碎成细小颗粒可以提高反应的转化率
B. 已知该催化氧化反应K(300℃)>K(350℃),则该反应正向是放热反应
C. 该反应加入催化剂是为了加快反应速率
D. 保持温度不变,平衡后增大O2的浓度,该反应的平衡常数K不变
-
对于硫酸工业中SO2的催化氧化反应 2SO2+O2 2SO3,下列说法错误的是( )
2SO3,下列说法错误的是( )
A.使用催化剂能加快化学反应速率
B.增大O2浓度可以使SO2转化率达到100%
C.降低反应温度,化学反应速率减慢
D.增大O2浓度,化学反应速率增大
-
对于硫酸工业中SO2的催化氧化反应 2SO2+O2 2SO3,下列说法错误的是
2SO3,下列说法错误的是
A.使用催化剂能加快化学反应速率
B.增大O2浓度可以使SO2转化率达到100%
C.降低反应温度,化学反应速率减慢
D.增大O2浓度,化学反应速率增大
-
由于催化剂可以为化学工业生产带来巨大的经济效益,催化剂研究和寻找一直是受到重视的高科技领域。
(1)V2O5是接触法制硫酸的催化剂。下图为硫酸生产过程中2SO2 (g) + O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1反应过程的能量变化示意图。
2SO3(g) ΔH=-196.6 kJ·mol-1反应过程的能量变化示意图。

①V2O5的使用会使图中B点________(填“升高”、“降低”)。
②一定条件下,SO2与空气反应tmin后,SO2和SO3物质的量浓度分别为a mol/L和b mol/L,则SO2起始物质的量浓度为 mol/L;生成SO3的化学反应速率为mol/(L·min)。
(2)下图是一种以铜、稀硫酸为原料生产蓝矾的生产流程示意图。

①生成CuSO4的总反应为2Cu+O2+2H2SO4=2 CuSO4+2H2O,少量 起催化作用,使反应按以下两步完成:
起催化作用,使反应按以下两步完成:
第一步:Cu+2Fe3+=2Fe2++Cu2+
第二步:。(用离子方程式表示)
②调节溶液pH为3~4的目的是________,调节时加入的试剂可以为________。(选填序号)
a.NaOH溶液 b.CuO粉末 c.Cu2(OH)2CO3 d.氨水
(3)纳米TiO2是优良的光敏催化剂。工业上用钛铁矿制得粗TiO2;再转化为TiCl4(l);由TiCl4(l)制取纳米TiO2的方法之一是将TiCl4气体导入氢氧火焰中(700~1000℃)进行水解。
已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
①写出TiO2和焦炭、氯气反应生成TiCl4和CO的热化学方程式:。
②写出上述TiCl4(l)制取纳米TiO2的化学方程式:________。
-
二氧化硫与氧气的反应为:2SO2(g)+O2(g) 2SO3(g) ΔH <0, 在硫酸工业生产中应采取的适宜条件是
2SO3(g) ΔH <0, 在硫酸工业生产中应采取的适宜条件是
A.低温、低压、催化剂 B.高温、高压、催化剂
C.低温、常压、催化剂 D.适宜的温度、常压、催化剂
-
工业制硫酸的关键步骤之一为SO2的接触氧化:2SO2(g)+O2(g) 2SO3(g);△H=-196.6kJ/mol
2SO3(g);△H=-196.6kJ/mol
现在一容积为2 L的密闭容器中充入2 mol SO2、1 molO2,加入固体催化剂,保持温度在450℃使之发生反应,5 min时达到平衡,测得平衡时体系的压强减小了30%。下列说法正确的是
A.SO2的转化率为30%
B.反应共放出了196.6 kJ的热量
C.用SO2表示的5 min内的平均反应速率为0.36 mol·L—1.min—1
D.相同条件下,起始时若加入2 molSO3,达到的平衡状态完全相同
-
工业制硫酸中一步重要反应是SO2在400~500℃下的催化氧化:2SO2 + O2  2SO3,下列说法不正确的是( )
2SO3,下列说法不正确的是( )
A. 增大O2的浓度能加快反应速率
B. 在利用上述反应生产三氧化硫时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题
C. 达到平衡后,正、逆反应速率相等且均为零
D. 该反应为可逆反应,故在一定条件下二氧化硫不可能全部转化为三氧化硫
-
二氧化硫与氧气的反应为:2SO2(g)+ O2(g)  2 SO3 (g); △H <0, 该反应在硫酸工业生产中应采取的适宜条件是( )
2 SO3 (g); △H <0, 该反应在硫酸工业生产中应采取的适宜条件是( )
A.低温、高压、催化剂 B. 适宜的温度、高压、催化剂
C.低温、常压、催化剂 D. 适宜的温度、常压、催化剂
-
工业制硫酸中的一步重要反应是SO2在400~500℃下催化氧化,2SO2 +O2 2SO3 ,这是一个正反应放热的可逆反应。下列有关说法中错误的是( )
2SO3 ,这是一个正反应放热的可逆反应。下列有关说法中错误的是( )
A.使用催化剂是为了加快反应速率,提高生产效率
B.上述条件下,SO2不可能100%转化为SO3;
C.达到平衡状态时,SO2浓度与SO3浓度相等
D.达到平衡状态时,SO2的消耗速率与SO2的生成速率相等
SO2* ΔH1=a kJ·mol-1
2O* ΔH2=b kJ·mol-1
SO3(g) ΔH4=d kJ·mol-1

[Fe(SCN)]2+(aq)+3C2O42-(aq),K=10-16。某研究小组同学欲检验晶体A中含有三价铁,取少量晶体放入试管中,用蒸馏水充分溶解,向试管中滴入几滴0.1 mol·L-1KSCN溶液。请判断上述实验方案是否可行并说明理由:____。
 2SO3,下列说法错误的是( )
2SO3,下列说法错误的是( )
