-
化学与生产、生活、社会密切相关,下列说法不正确的是
A.中国天眼FAST用到的碳化硅是一种新型无机非金属材料
B.氯水放置数天后,漂白性和酸性均减弱
C.由石油的裂解可以得到乙烯、丙烯等主要化工基本原料
D.某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因水中生成了硫酸
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A.丙烯球棍模型:
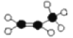 B.乙醇的分子式:C2H5OH
B.乙醇的分子式:C2H5OHC.的电子式:
D.
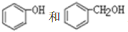 互为同系物
互为同系物难度: 中等查看答案及解析
-
下列有关常见金属的说法错误的是
A.电解饱和食盐水可以获得金属钠
B.镁因在空气中形成了一薄层致密的氧化膜,故镁不需要像钠似的进行特殊保护
C.铝罐、铁罐可以盛装冷的浓硫酸、浓硝酸
D.铁、铜都是具有可变化合价的过渡元素
难度: 中等查看答案及解析
-
下列反应中,通入的气体物质只作为氧化剂的是
A.二氧化硫通入溴水溶液中 B.氯气通入氯化亚铁溶液中
C.一氧化碳气体通入灼热的CuO中 D.二氧化氮通入水中
难度: 中等查看答案及解析
-
能正确表达下列反应的离子方程式为
A.用醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O
B.Na2S2O3溶液中滴入稀硫酸:S2O32-+2H+=S↓+SO2↑+H2O
C.向足量的稀硝酸中加入少量铁粉:2NO3-+8H++3Fe=3Fe2++2NO↑+4H2O
D.Al2(SO4)3溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
难度: 中等查看答案及解析
-
将SO2通入足量Fe2(SO4)3溶液中,完全反应后再加入K2Cr2O7溶液,发生的两个化学反应为
①SO2+2Fe3++2H2O=SO42-+2Fe2++4W;
②Cr2O72-+aFe2++bH+→xCr3++yFe3++zH2O。
下列有关说法正确的是
A.还原性:Cr3+>SO2 B.方程式①中W为OH-
C.方程式②中,a=6,b=14 D.SO2、Fe2+在反应中均只能做还原剂
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物是一种清洁能源,X在地壳中含量最丰富,Y是非金属性最强的元素,Z的原子半径是所有短周期金属元素中最大的。下列说法不正确的是
A.W、X两种元素都可以形成多种同素异形体。
B.X、Y的最高化合价等于其主族序数
C.Z的简单离子与Y的简单离子均是10电子微粒
D.Z的最高价氧化物中只有一种是碱性氧化物
难度: 中等查看答案及解析
-
下列说法中正确的是
A.因为3O2=2O3是吸热反应,所以臭氧比氧气的化学性质更活泼
B.需要加热的化学反应一定是吸热反应,不需要加热就能进行的反应一定是放热反应
C.吸热反应就是反应物的总能量比生成物的总能量高
D.物质发生化学反应时都伴随着能量变化,伴随能量变化的物质变化也一定是化学变化
难度: 中等查看答案及解析
-
下列热化学方程式,正确的是
A.已知中和热为57.3 kJ/mol:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-57.3 kJ/mol
B.1 mol SO2与2 mol O2在某密闭容器中反应放出88 kJ热量,则反应的热化学方程式为:2SO2(g)+O2(g)
2SO3(g) △H=-176 kJ/mol
C.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
D.8 g 固体硫完全燃烧生成SO2,放出74kJ热量:S(s)+O2(g)=SO2(g) ΔH=-296 kJ/mol
难度: 中等查看答案及解析
-
甲醇燃料电池(DMFC)可用于笔记本电脑、汽车、遥感通讯设备等,它的一极通入甲醇,一极通入氧气;电解质是质子交换膜,它能传导氢离子(H+)。电池工作时,甲醇被氧化为二氧化碳和水,氧气在电极上的反应是O2+4H++4e-===2H2O。下列叙述中不正确的是
A.负极的反应式为CH3OH+H2O-6e-===CO2↑+6H+
B.电池的总反应式是2CH3OH+3O2===2CO2+4H2O
C.电池工作时,H+由正极移向负极
D.电池工作时,电子从通入甲醇的一极流出,经外电路再从通入氧气的一极流入
难度: 中等查看答案及解析
-
溴是海水中重要的非金属元素,地球上90%的溴元素以Br-的形式存在于海水中,所以人们称溴为“海洋元素”。下列有关说法中正确的是
A.从海水中提取溴时,涉及的氧化还原反应只有一个
B.苯与溴水反应生成溴苯
C.可以用CCl4萃取溴水中的溴
D.向FeBr2溶液中通入Cl2时,一定会发生如下反应:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
难度: 中等查看答案及解析
-
下列各化合物的命名中正确的是
A.
的系统命名为3-甲基-1-丁炔
B.
的系统命名为1,3,4-三甲苯
C.CH2=CH-CH=CH2 1,3-二丁烯
D.CH3COOCH2CH2OOCCH3乙二酸二乙酯
难度: 中等查看答案及解析
-
下列说法正确的是
A.糖类、油脂和蛋白质在一定条件下都能发生水解反应
B.果糖与葡萄糖,蔗糖与麦芽糖,淀粉与纤维素均互为同分异构体
C.利用蛋白质与浓硝酸的颜色反应可以鉴别部分蛋白质
D.纤维素、油脂和蛋白质都属于高分子化合物
难度: 中等查看答案及解析
-
下列操作能达到实验目的的是
A.将电石与水反应产生的气体通入酸性KMnO4溶液中,溶液褪色说明有乙炔生成
B.将溴乙烷与NaOH的乙醇溶液共热产生的气体通入酸性KMnO4溶液中,溶液褪色说明有乙烯生成
C.使石蜡油裂解产生的气体通入酸性KMnO4溶液中,溶液褪色说明石蜡油裂解产生的气体中一定有乙烯生成
D.溴乙烷与氢氧化钠溶液共热后,先加入稀硝酸酸化,再加入硝酸银溶液检验溴元素
难度: 中等查看答案及解析
-
维生素C(VitaminC)又名抗坏血酸,具有酸性和强还原性,也是一种常见的食品添加剂,其结构如图。下列有关说法中正确的是

A.维生素C的分子式为C5H8O6
B.维生素C的酸性可能是③、④两个羟基引起的
C.维生素C中含有醚键
D.维生素C与足量的金属钠反应产生氢气的物质的量是维生素C的4倍
难度: 中等查看答案及解析
-
分子式为C4H8O3的有机物能与NaHCO3溶液反应;0.1 mol该有机物与足量金属钠反应时可以收集到标况下的气体2.24 L。则符合上述条件的有机物有(不考虑立体异构)
A.2种 B.3种 C.4种 D.5种
难度: 中等查看答案及解析
-
由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次发生的反应类型和反应条件都正确的是
选项
反应类型
反应条件
A
加成、取代、消去
KOH醇溶液/加热、KOH水溶液/加热、常温
B
消去、加成、取代
NaOH醇溶液/加热、常温、KOH水溶液/加热
C
氧化、取代、消去
加热、KOH醇溶液/加热、KOH水溶液/加热
D
消去、加成、水解
NaOH水溶液/加热、常温、NaOH醇溶液/加热
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
一定温度下,某恒容容器内的可逆反应A(气)+3B(气)
2C(气)。下列说法正确的是
A.当反应进行到混合气体密度不变时,达化学平衡状态
B.当B的生成速率是A的消耗速率的3倍时,反应达化学平衡状态
C.向容器内充入氦气致使压强增大,化学反应速率加快
D.当反应达平衡后,若改变某一外界条件引起速率发生变化,平衡一定会发生移动
难度: 中等查看答案及解析
-
一定量的混合气体在容积为VL的密闭容器中发生如下反应:xA(g)+yB(g)
zC(g),达到平衡后测得A气体的浓度为1.0mol/L,保持温度不变将密闭容器的容积变为2VL,再次达到平衡后,测得A浓度为0.5mol/L,则下列叙述正确的是
A.平衡向正反应方向移动 B.x+y>z C.x+y=z D.x+y<z
难度: 中等查看答案及解析
-
在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g)
2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min
2
4
7
9
n(Y)/mol
0.12
0.11
0.10
0.10
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
难度: 简单查看答案及解析

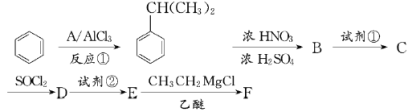
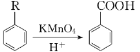 ;
;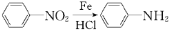 (苯胺:弱碱性,易被氧化)
(苯胺:弱碱性,易被氧化)