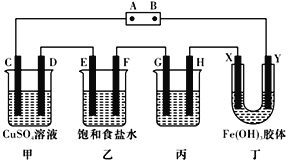
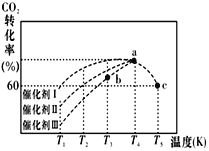
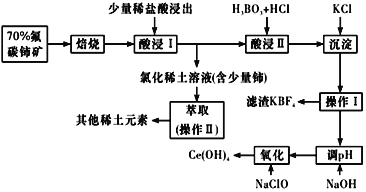
-
将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见( )
A.NH4HCO3和盐酸的反应是放热反应
B.该反应中,热能转化为产物内部的能量
C.反应物的总能量高于生成物的总能量
D.反应的热化学方程式为:NH4HCO3+HCl=NH4Cl+CO2↑+H2O ΔH=+Q
难度: 中等查看答案及解析
-
下列有关叙述正确的是( )
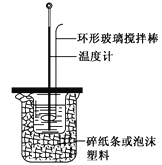
A. 如图所示,测定中和热时,大小两烧杯间填满碎纸条或泡沫塑料的目的是固定小烧杯
B. 若用50 mL 0.55 mol·L-1的氢氧化钠溶液,分别与50 mL 0.50 mol·L-1的盐酸和50 mL 0.50 mol·L-1的硫酸充分反应,两反应测定的中和热不相等
C. 为了简化装置,中和热测定实验中的环形玻璃搅拌棒可以由温度计代替
D. 中和热测定实验也可以用稀硫酸与氢氧化钠溶液反应
难度: 中等查看答案及解析
-
向Na2CO3溶液中滴加盐酸,反应过程中能量变化如图所示,下列说法正确的是( ).

A.△H1 >△H2 △H2<△H3
B.反应HCO3-(aq)+H+(aq)=CO2 (g)+H2O(l)为放热反应
C.H2CO3(aq)= CO2(g)+H2O(l),若使用催化剂,则△H3变小
D.CO32-(aq)+2H+(aq)=CO2(g)+H2O(l) △H=(△H1+△H2+△H3)
难度: 简单查看答案及解析
-
一定条件下,可逆反应X(g)+3Y(g)
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),当达平衡时X、Y、Z的浓度分别为0.1mol /L,0.3mol/ L,0.08 mol/L,则下列判断不合理的是
A.c1:c2=1:3 B.平衡时,Y和Z的生成速率之比为3:2
C.X、Y的转化率不相等 D.c1的取值范围为0< c1<0.14 mo /L
难度: 简单查看答案及解析
-
在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g)
2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min
2
4
7
9
n(Y)/mol
0.12
0.11
0.10
0.10
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
难度: 简单查看答案及解析
-
室温下向
溶液中加入
的一元酸HA溶液pH的变化曲线如图所示。下列说法正确的是
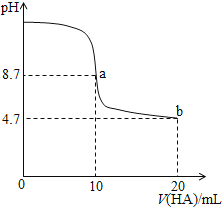
A.a点所示溶液中
B.a、b两点所示溶液中水的电离程度相同
C.
时,
D.b点所示溶液中
难度: 中等查看答案及解析
-
下列与金属腐蚀有关的说法正确的是( ).

A.图1中,铁钉易被腐蚀
B.图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现
C.图3中,形成了原电池,加速了铁锅、铁铲的腐蚀
D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极
难度: 简单查看答案及解析
-
交通运输部在南海华阳礁举行华阳灯塔和赤瓜灯塔竣工发光仪式,宣布两座大型多 功能灯塔正式发光并投入使用。镁-海水电池可为灯塔提供能源,其装置如图所示。下列有关镁-海水电池的说法正确的是( ).
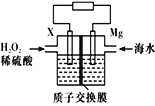
A.镁被还原
B.该电池工作一段时间后,左侧溶液质量减轻
C.正极的电极反应式为H2O2+2e-+2H+=2H2O
D.若电池工作时,SO42-从交换膜左侧向右侧迁移
难度: 简单查看答案及解析
-
某同学用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)设计成一个原电池如口图所示,下列判断中正确的是( ).

A.该原电池的工作原理是Cu+2Ag+=2Ag+Cu2+
B.实验过程中取出盐桥,原电池能继续工作
C.实验过程中,左侧烧杯中NO3-浓度不变
D.实验过程中电子流向为:Cu极→Cu(NO3) 2溶液→AgNO3溶液→Ag极
难度: 简单查看答案及解析
-
增塑剂DCHP可由环己醇制得。环己醇和DCHP的结构简式如图所示,下列说法中正确的是( )
.

A.DCHP的分子式为C20H24O4
B.与环己醇互为同分异构体,且含醛基的结构有8种(不考虑立体异构)
C.环己醇和DCHP均属于芳香化合物
D.环己醇分子中的所有碳原子一定共平面
难度: 简单查看答案及解析
-
在一定条件下,可逆反应X(g)+2Y(g)
2Z(g) ΔH=-akJ•mol-1,达到化学平衡时,下列说法一定正确的是 ( )
A.反应放出akJ热量 B.反应物和生成物的浓度都不再发生变化
C.X和Y的物质的量之比为1∶2 D.X的正反应速率等于Z的逆反应速率
难度: 中等查看答案及解析
-
湿垃圾又称为厨余垃圾,厨余垃圾发酵液可通过电渗析法处理,同时得到乳酸的原理如图所示(图中HA表示乳酸分子,A-表示乳酸根离子)。 下列说法正确的是( ).
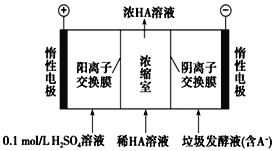
A.当有11.2LO2生成时,电路中通过2 mol e-的电量
B.电子从负极经电解质溶液回到正极
C.通电后,A-通过阴离子交换膜从阴极区进入浓缩室
D.通电后,阳极附近pH增大
难度: 简单查看答案及解析
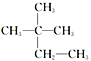 化合物的名称为2-甲基2-乙基丙烷
化合物的名称为2-甲基2-乙基丙烷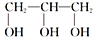 是同分异构体
是同分异构体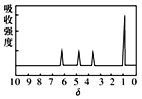
 ,该反应类型属于______(填字母代号,下同)反应。
,该反应类型属于______(填字母代号,下同)反应。