-
在密闭容器里,A与B反应生成C,其反应速率分别用v(A)、v(B)、v(C)表示,已知3v(B)=2v(A)、2v(C)=3v(B),则此反应可表示为( )
A.2A+3B=2C B.A+3B=2C C.3A+2B=3C D.A+B=C
难度: 简单查看答案及解析
-
对于化学反应3W(g)+2X(g)=4Y(g)+3Z(g),下列反应速率关系中,正确的是
A.v(W)=3v(Z) B.2v(X)=3v(Z) C.2v(X)=v(Y) D.3v(W)=2v(X)
难度: 简单查看答案及解析
-
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列符合未来新能源标准的是( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
难度: 简单查看答案及解析
-
下列有关化学反应速率的说法中,正确的是( )
A.用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率
B.100 mL 2mol·L-1 的盐酸与锌反 应时,加入适量的氯化钠溶液,生成氢气的速率不变
C.二氧化硫的催化氧化是一个放热反应,所以升高温度,反应速 率减慢
D.汽车尾气中的 CO 和 NO 可以缓慢反应生成N2和CO2,减小压强,反应速率减慢
难度: 中等查看答案及解析
-
1 mol H—H键的键能是436kJ,1 mol I—I键的键能是151kJ,1 mol H—I键的键能是299kJ,则对反应H2(g)+I2(g)
2HI(g)的说法,不正确的是 ( )
A.放热反应 B.吸热反应 C.化合反应 D.可逆反应
难度: 简单查看答案及解析
-
下列叙述正确的是 :
A.化学反应一定只伴随热量的变化
B.凡是吸热或放热过程中热量的变化均称为反应热
C.若△H<0,则反应物的总能量高于生成物的总能量
D.若△H>0,则反应物的总能量高于生成物的总能量
难度: 简单查看答案及解析
-
对热化学方程式
H2(g)+
I2(s)=HI(g) ΔH=+26kJ·mol-1的叙述中正确的是:
A.1mol氢气和1mol碘蒸气完全反应需要吸收26kJ的热量
B.1个氢分子和1个碘分子完全反应需要吸收52kJ的热量
C.1mol H2(g)与1mol I2(s)完全反应生成2mol HI气体需吸收52kJ的热量
D.1mol H2(g)与1mol I2(g)完全反应放出26kJ的热量
难度: 简单查看答案及解析
-
下列变化为吸热反应的是
A.H2O(l)=H2O(g);ΔH=+44.0 kJ/mol
B.在高温条件下碳与水蒸气的反应
C.形成化学键时共放出能量862 kJ的化学反应
D.能量变化如图所示的化学反应
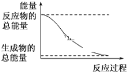
难度: 简单查看答案及解析
-
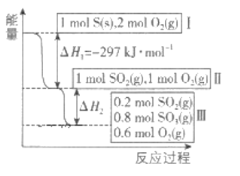
下列热化学方程式书写正确的是
A.C(s)+O2(g)=CO2(g) △H =+393.5kJ/mol
B.2SO2+O2=2SO3 △H = —196.6kJ/mol
C.S(s)+O2(g)=SO2(g);ΔH=+297.23 kJ
D.2H2(g)+O2(g)=2H2O(l) △H= -571.6kJ/mol
难度: 简单查看答案及解析
-
用CH4催化还原NOx可以消除氮氧化物的污染。
已知CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1,CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1。若在标准状况下4.48 L CH4恰好能将一定量NO2还原成N2和H2O(g),则整个过程中放出的热量为( )
A.114.8 kJ B.232 kJ C.368.8 kJ D.173.4 kJ
难度: 中等查看答案及解析
-
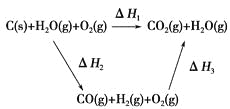
已知:2C(s)+O2(g)=2CO(g) △H=-Q1 kJ·mol-1
C(s)+O2(g)=CO2(g) △H=-Q2 kJmol-1
S(s)+O2(g)=SO2(g) △H=-Q3 kJ·mol-1
CO与镍反应会造成镍催化剂中毒,为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫,则对应反应的热化学方程式为
A.S(s)+2CO(g)=SO2(s)+2C(s) △H=2(2Q1-2Q2+Q3)kJ·mol-1
B.S(s)+2CO(g)=SO2(s)+2C(g) △H=(Q1-Q3)kJ·mol-1
C.SO2(g)+2CO(g)=S(s)+2CO2(g) △H=(Q1-2Q2+Q3)kJ·mol-1
D.SO2(g)+2CO(g)=S(s)+2CO2(g) △H=(2Q1-Q2+2Q3)kJ·mol-1
难度: 中等查看答案及解析
-
C和H2在生产、生活、科技中是非常重要,已知:①2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-1
②
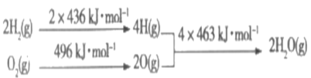
下列推断正确的是
A.C(s)的燃烧热为110.5kJ·mol-1
B.2H2(g)+O2(g)=2H2O(g) △H=+484kJ·mol-1
C.C(s)+H2O(g)=CO(g)+H2(g) △H=+131.5kJ·mol-1
D.将2mol H2O(l)分解成H2(g)和O2(g),至少需要提供4×463kJ的热量
难度: 中等查看答案及解析
-
反应2SO2+O2
2SO3经一段时间后,SO3的浓度增加了0.8mol·L-1,在这段时间内用O2表示的反应速率为0.04mol·L-1·s-1,则这段时间为( )。
A.0.1s B.2.5s C.5s D.10s
难度: 中等查看答案及解析
-
在2A+B
3C+4D反应中,表示该反应速率最快的是
A.v(A)=2 mol·L-1·s-1 B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1 D.v(D)=1 mol·L-1·s-1
难度: 简单查看答案及解析
-
在2L的密闭容器中,发生以下反应:2A(g)+B(g)
2C(g)+D(g)。若最初加入的A和B都是8 mol,在前10秒钟A的平均反应速率为0.12 mol/(L•s),则10秒钟时,容器中B的物质的量是
A.5.6 mol B.6.8 mol C.2.4 mol D.3.2 mol
难度: 简单查看答案及解析
-
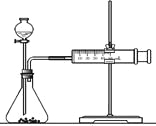
用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积),下列分析正确的是( )
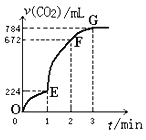
A.F点收集到的CO2的量最多
B.OE段表示的平均速率最快
C.EF段用盐酸表示该反应的平均反应速率为0.4mol·L-1・min-1
D.OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2:6:7
难度: 中等查看答案及解析
-
某温度下,对可逆反应:2X(g)+Y(g)
Z(g)+W(s) ΔH>0的下列叙述正确的是
A.加入少量W,逆反应速度增大
B.升高温度时,正反应速率增大,逆反应速率减小
C.压强不变,充入与反应体系不反应的N2,反应速率减小;体积不变,充入N2,反应速度不变
D.平衡后加入X,上述反应的ΔH增大
难度: 中等查看答案及解析
-
相同条件下,下列各组热化学方程式(溶液中的反应均是在稀溶液中进行的)中,ΔH1>ΔH2的是
A.2H2(g)+O2(g)=2H2O(l) ΔH1;CaCO3(s)=CaO(s)+CO2(g) ΔH2
B.C2H5OH(l)+3O2(g==2CO2(g)+3H2O(l) ΔH1;C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(l) ΔH2
C.HCl(aq)+NaOH(s)=NaCl(aq)+H2O(l) ΔH1;HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(l) ΔH2
D.CO2(g)=CO(g)+1/2O2(g) ΔH1;2CO2(g)=2CO(g)+O2(g) ΔH2
难度: 中等查看答案及解析
-
下列叙述正确的是
A.将0. 5mol N2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3 H2(g)
2 NH3(g) ΔH=-38.6kJ•mol-1
B.C(石墨)=C(金刚石) ΔH=+1.9kJ•mol-1,说明金刚石比石墨稳定
C.甲烷的燃烧热△H=-890. 3 kJ•mol-1,甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890. 3 kJ•mol-1
D.已知H+(aq)+OH-(aq)=H2O(l) △H=-57.4 kJ•mol-1,20g氢氧化钠固体溶于稀盐酸中恰好完全反应时放出的热量大于28.7kJ
难度: 中等查看答案及解析
-
已知稀溶液中①H+(aq)+OH-(aq)
H2O(l) △H1=-57.3kJ·mol-1;
②
Ba(OH)2(aq)+
H2SO4(aq)=
BaSO4(s)+H2O(l) △H2下列结论正确的是
A.中和反应的△H=-57.3kJ•mol-1 B.△H2<△H1
C.△H2>△H1 D.中和热的数值与实际发生反应的酸碱量有关
难度: 中等查看答案及解析