-
NA表示阿伏加德罗常数。则下列叙述中,正确的是
A.32gS2-中电子数为2NA
B.46 gNO2和N2O4的混合物中含有的原子数为3NA
C.1 L 0.5 mol•L-1 Na2CO3溶液中含有的CO32-数为0.5NA
D.78 g Na2O2中阴离子数目为2NA
难度: 中等查看答案及解析
-
以下有关原子结构及元素周期律的叙述正确的是
A.同周期元素除0族元素外)从左到右,原子半径逐渐减小
B.第IA族元素铯的两种同位素137Cs比133Cs多4个质子
C.第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强
D.若M+和R2-的核外电子层结构相同,则原子序数:R>M
难度: 中等查看答案及解析
-
下列各反应的离子方程式书写中,正确的是
A.金属钠投入水中:Na+2H2O═Na++OH-+H2↑
B.用FeCl3溶液腐蚀铜线路板:Cu+Fe3+═Cu2++Fe2+
C.向Na2CO3溶液中加入过量CH3COOH溶液:CO32-+2H+═CO2↑+H2O
D.过量CO2通入Ca(ClO)2溶液中:ClO-+CO2+H2O═HCO3-+HClO
难度: 中等查看答案及解析
-
已知某溶液中存在较多的H+、SO42-、NO3-,则该溶液中还可能大量存在的离子组是
A.Al3+、CH3COO-、Cl- B.Mg2+、Ba2+、Br-
C.Na+、NH4+、Cl- D.Mg2+、Cl-、I-
难度: 中等查看答案及解析
-
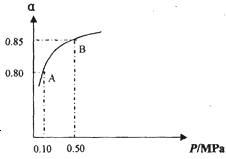
下列有关平衡常数的说法中,正确的是
A.改变条件,反应物的转化率增大,平衡常数也一定增大
B.反应2NO2(g)═N2O4(g)△H<0,升高温度该反应平衡常数增大
C.对于给定可逆反应,温度一定时,其正、逆反应的平衡常数相等
D.平衡常数为
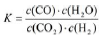 的反应,化学方程式为CO2+H2
的反应,化学方程式为CO2+H2CO+H2O
难度: 中等查看答案及解析
-
钢铁在潮湿的空气中会发生吸氧腐蚀。以下说法中,正确的是
A.负极发生的反应为:Fe-2e-=Fe2+
B.正极反应为:O2+4e-+4H+=2H2O
C.腐蚀过程中,电子从正极流向负极
D.钢柱在水下的部分比在空气与水交界处更容易发生吸氧腐蚀
难度: 中等查看答案及解析
-
下列液体均处于25℃,有关叙述中,正确的是
A.某溶液中水电离出的c(H+)=10-13,则该溶液的pH一定为13
B.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的2倍
C.pH相同的氨水与盐酸等体积混合,所得溶液pH<7
D.pH=7的CH3COOH与CH3COONa混合溶液中,c(Na+)=c(CH3COO-)
难度: 中等查看答案及解析
-
甲、乙两烧杯中分盛有10mL1mol•L-1AlCl3溶液,在甲烧杯中加入一定量NaOH溶液;乙烧杯中加入与上述NaOH溶液等体积、等pH的氨水.下列有关两个烧杯的说法中,正确的是
A.甲中产生的沉淀一定比乙中多 B.乙中产生的沉淀一定比甲中多
C.甲和乙产生的沉淀一定一样多 D.甲和乙中产生的沉淀可能一样多
难度: 中等查看答案及解析
-
下列说法中,正确的是
A.难溶电解质在水溶液中达到沉淀溶解平衡时,沉淀和溶解即停止
B.Ksp越小,难溶电解质在水中的溶解能力一定越弱
C.Ksp的大小与离子浓度无关,只与难溶电解质的性质和温度有关
D.相同温度下,AgCl在水中的溶解能力与在NaCl溶液中的相同
难度: 中等查看答案及解析
-
在体积可变的密闭容器中,反应mA(g)+nB(g)
pC(g)达到平衡后,压强容器的体积,发现A的转化率随之降低,下列说法中,正确的是
A.m+n必定小于p B.m+n必定大于p
C.m必定小于p D.m必定大于p
难度: 中等查看答案及解析
-
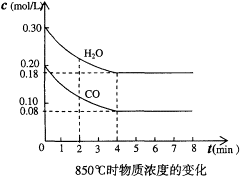
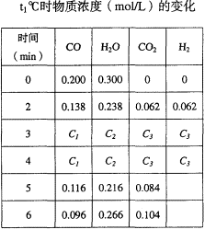
在密闭容器中,一定条件下进行如下反应:NO(g)+CO(g)
1/2N2(g)+CO2(g);△H=-373.2kJ•mol-1,达到平衡后,为提高该反应的速率和NO的转化率,正确措施是
A.加催化剂同时增大压强 B.加催化剂同时升高温度
C.升高温度同时充入N2 D.降低温度同时增大压强
难度: 中等查看答案及解析
-
在一定温度下,Na2CO3溶液中存在水解平衡:CO32-+H2O
HCO3-+OH- 。下列说法中,正确的是
A.升高温度,
减小
B.通入CO2,平衡向正反应方向移动
C.稀释溶液,Na2CO3水解程度增大,水解平衡常数增大
D.加入NaOH固体,平衡向逆反应方向移动,溶液pH减小
难度: 中等查看答案及解析
-
醋酸溶液中存在电离平衡:CH3COOH
H++ CH3COO-,下列叙述不正确的是
A.醋酸溶液中离子浓度的关系满足:c(H+)= c(OH-)+ c(CH3COO-)
B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D.常温下pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
难度: 中等查看答案及解析
-
下列与有机物结构、性质相关的叙述错误的是
A.乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2
B.甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同
C.蛋白质和油脂都属于高分子化合物,一定条件下都能水解
D.苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键
难度: 中等查看答案及解析
-
对滴有酚酞试液的下列溶液,操作后颜色变深的是
A.明矾溶液加热 B.小苏打溶液中加入少量NaCl固体
C.氨水中加入少量NH4Cl固体 D.CH3COONa溶液加热
难度: 中等查看答案及解析
-
下列有关pH变化判断中,正确的是
A.随着温度的升高,Na2CO3溶液pH减小
B.随着温度的升高,纯水的pH增大
C.新制氯水经光照一段时间后,溶液pH减小
D.氢氧化钠溶液久置于空气中,溶液pH增大
难度: 中等查看答案及解析
-
新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化。常温下,MFe2Ox能使工业废气中的SO2转化为S,转化过程表示如下:
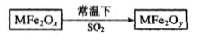
则下列判断正确的是
A.MFe2Ox是还原剂 B.SO2是该反应的催化剂
C.x>y D.氧化性:MFe2Oy>SO2
难度: 中等查看答案及解析
-
化学与生产、生活密切相关。下列叙述正确的是
A.煤的干馏和石油的分馏均属于化学变化
B.BaSO4在医学上用作钡餐,Ba2+对人体无毒
C.14C可用于文物年代的鉴定,14C与12C互为同素异形体
D.葡萄糖注射液不能产生丁达尔效应现象,不属于胶体
难度: 简单查看答案及解析
-
某酸溶液的pH=1,此酸溶液的物质的量浓度
A.0.1 mol·L-1
B.一定大于0.1 mol·L-1
C.若为强酸一定等于0.1 mol·L-1,若为弱酸一定大于0.1 mol·L-1
D.若为强酸一定≤0.1 mol·L-1,若为弱酸一定>0.1 mol·L-1
难度: 中等查看答案及解析
-
铁镍蓄电池又称爱迪生电池,放电时的总反应为:
Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2
下列有关该电池的说法不正确的是
A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B.电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O
难度: 中等查看答案及解析
-
在pH为3的FeCl3溶液,pH为11的Na2CO3溶液和pH为3的盐酸中由水电离出来的H+的浓度分别为:C1、C2、C3它们之间的关系是
A.C1<C2<C3 B.C1=C2>C3 C.C1>C2>C3 D.无法判断
难度: 中等查看答案及解析
-
下列说法正确的是
A.c(H+)=
的溶液一定呈中性
B.将水加热,KW增大,pH不变,仍呈中性
C.向水中加入少量碳酸氢钠固体,溶液的c(H+)增大,平衡逆向移动,KW减小
D.向0.01 mol•L-1醋酸溶液中加水,溶液中水电离产生的c(H+)将减小
难度: 中等查看答案及解析
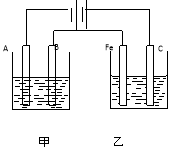
-
下列说法正确的是
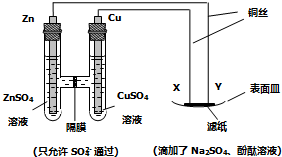
A.Y与滤纸接触处有氧气生成 B.X为正极,发生氧化反应
C.Y为阴极,发生还原反应 D.X与滤纸接触处变红
难度: 中等查看答案及解析
-
将浓度为0.1mol/LHF溶液加水不断稀释,下列各量始终保持增大的是
A.c(H+) B.Ka(HF) C.
D.
难度: 中等查看答案及解析