-
下列物质属于碱的是
A.CH3CH2OH B.NH3·H2O C.CuCl2 D.Na2CO3
难度: 简单查看答案及解析
-
仪器名称为“蒸发皿”的是
A.
 B.
B. C.
C.D.
难度: 简单查看答案及解析
-
下列物质属于非电解质的是
A.氯化钠 B.盐酸 C.石墨 D.二氧化碳
难度: 简单查看答案及解析
-
下列物质在水溶液中的电离方程式不正确的是
A.Ba(OH)2=Ba2++2OHˉ
B.H2CO3=2H++CO32ˉ
C.NaHSO4=Na++H++SO42—
D.Na2CO3=2Na++CO32ˉ
难度: 简单查看答案及解析
-
下列实验操作或现象中,能区分 FeCl3 溶液和 Fe(OH)3 胶体的是
A.丁达尔效应 B.过滤 C.观察颜色 D.静置
难度: 简单查看答案及解析
-
关于反应:3CO+Fe2O3=2Fe+3CO2 的叙述正确的是
A.CO 和 CO2 均属于酸性氧化物,Fe2O3 属于碱性氧化物
B.该反应既是氧化还原反应,也是置换反应
C.Fe2O3 为氧化剂,CO2 为氧化产物
D.28gCO 参加反应,得到 2mol 电子
难度: 简单查看答案及解析
-
下列说法中不正确的是
A.卢瑟福——用α粒子散射实验提出带核的原子结构模型
B.维勒——合成尿素实现了无机物向有机物的转化
C.门捷列夫——发现了元素周期律,并编制出第一张元素周期表
D.侯德榜——侯氏制碱法的原理是将氨气通入二氧化碳的氯化钠饱和溶液中
难度: 简单查看答案及解析
-
下列说法正确的是
A.蒸馏时,当烧瓶中液体出现暴沸时,要立即添加碎瓷片
B.在溶解、过滤、蒸发、萃取、分液等操作中均需使用玻璃棒
C.可以用铁丝代替铂丝进行焰色反应
D.用 pH 试纸测定新制氯水的 pH
难度: 简单查看答案及解析
-
下列有关化学用语表述正确是
A.中子数为 18 的氯原子:
B.硫酸的摩尔质量:98
C.S2ˉ的结构示意图:
D.H2、D2、T2 互为同位素
难度: 简单查看答案及解析
-
下列有关单质用途的说法不正确的是
A.充有钠蒸气的高压钠灯常用于道路和广场的照明
B.还原铁粉可用作食品袋内的抗氧化剂
C.镁是一种重要的金属材料,是优质的耐高温材料
D.氯气可用于自来水的消毒、药物的合成
难度: 简单查看答案及解析
-
下列说法正确的是
A.可用澄清石灰水鉴别二氧化硫和二氧化碳
B.将二氧化硫通入氯化钡溶液中无明显现象,不断振荡,溶液变浑浊
C.工业上或实验室用亚硫酸钠固体与稀硫酸反应制备二氧化硫
D.二氧化硫能使含酚酞的氢氧化钠溶液褪色,体现了其漂白性
难度: 中等查看答案及解析
-
下列说法不正确的是
A.生物炼铜就是利用某种细菌将难溶性的硫化铜直接转化为铜
B.根据纤维在火焰上燃烧产生的气味,确定该纤维是否为蛋白质纤维
C.用原子吸收光谱仪可以确定物质中含有哪些金属元素
D.分子筛常用于分离、提纯气体或液体混合物,也可作干燥剂、离子交换剂和催化剂
难度: 中等查看答案及解析
-
向下列溶液中通入足量相应气体后,各离子组还能大量存在的是
A.二氧化碳:K+、Na+、CO32ˉ、Clˉ
B.氨气:Ba2+、Mg2+、NO3ˉ、Br—
C.氯化氢:Ca2+、Fe3+、NO3ˉ、Clˉ
D.二氧化硫:Na+、NH4+、HCO3ˉ、MnO4ˉ
难度: 中等查看答案及解析
-
下列说法不正确的是
A.漂白粉应该密封保存
B.金属钠、浓硫酸属于危险品,应保存在同一个专用实验柜中
C.液溴保存在棕色磨口玻璃塞的试剂瓶中,并加适量水进行水封
D.配制硫酸亚铁溶液时常需加入铁粉
难度: 简单查看答案及解析
-
下列说法正确的是
A.工业以硫黄为原料生产硫酸,沸腾炉中的反应:2S+3O2
2SO3
B.工业上用电解饱和食盐水的方法制取金属钠
C.高炉炼铁过程中,焦炭的主要作用是还原铁矿石中的氧化铁
D.工业上以石灰乳和氯气为原料制取漂白粉
难度: 中等查看答案及解析
-
下表为元素周期表的一部分,其中 X、Y、Z、W 为短周期元素,X、Y的核电荷数之和等于W的核电荷数。下列说法不正确的是
X
Y
Z
W
A.简单气态氢化物的稳定性:Y<Z
B.最高价氧化物对应水化物的酸性:X<W
C.原子半径:W>Y>Z
D.由 Y、W 形成的最简单钠盐水溶液是建筑行业经常使用的一种黏合剂
难度: 中等查看答案及解析
-
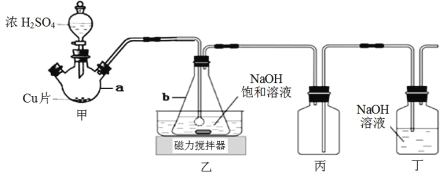
下列实验操作对应的现象符合事实的是
A.
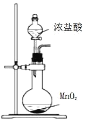 将浓盐酸滴入后产生黄绿色气体
将浓盐酸滴入后产生黄绿色气体B.
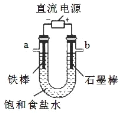 通电一段时间后,收集b处气体,可做爆鸣实验
通电一段时间后,收集b处气体,可做爆鸣实验C.
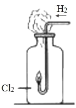 出现苍白色火焰,集气瓶口有白雾
出现苍白色火焰,集气瓶口有白雾D.
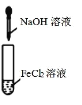 试管中产生白色沉淀,较长时间不变色
试管中产生白色沉淀,较长时间不变色难度: 简单查看答案及解析
-
某实验需 1mol·Lˉ1 NaOH 溶液 90mL,配制该 NaOH 溶液的几个关键实验步骤和操作示意图如下:
①
 ②
②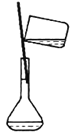 ③
③ ④
④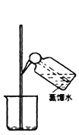 ⑤
⑤ ⑥
⑥
下列说法正确的是
A.用托盘天平称取 3.6g 氢氧化钠固体
B.容量瓶使用前先检漏,再用蒸馏水洗涤,干燥后才可用
C.操作①时,若俯视容量瓶的刻度线,使配得的NaOH溶液浓度偏低
D.上述操作的先后顺序是③②④⑥①⑤
难度: 简单查看答案及解析
-
下列离子方程式正确的是
A.次氯酸钠溶液中通入少量的二氧化硫:SO2+3ClOˉ+H2O=SO42ˉ+Clˉ+2HClO
B.碳酸氢钠溶液与足量盐酸反应:CO32ˉ+2H+=CO2↑+H2O
C.稀硫酸和氢氧化钡溶液反应:Ba2++OHˉ+H++SO42ˉ= BaSO4↓+H2O
D.锌和浓硫酸反应:Zn+2H+=H2↑+Zn2+
难度: 中等查看答案及解析
-
下列几种类推结论符合事实的是
A.氯水可以将 Fe2+氧化至 Fe3+,则碘水也可以将 Fe2+氧化至 Fe3+
B.Fe3O4 可改写为 FeO·Fe2O3,则 Fe3Cl8 也可改写为 FeCl2·2FeCl3
C.Cl2+H2O⇌HCl+HClO 是氧化还原反应,则 ICl+H2O⇌HCl+HIO 也是氧化还原反应
D.CO2 溶于 H2O 生成 H2CO3,则 SiO2 也能溶于 H2O 生成 H2SiO3
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法不正确的是
A.4.6gNa 与含 0.1molHCl 的稀盐酸充分反应,转移电子数目为 0.2 NA
B.质量为 3.0g 的 15N2 和 C18O 混合物中含有中子数为 1.6NA
C.常温常压下,1.12L 的 CO2 和 SO2 混合气体中,含有氧原子的数目小于 0.1NA
D.在 1L相同浓度的硫酸钾和硫酸铁混合液中K+浓度为 0.2 mol·Lˉ1,则溶液中 SO42—的数目为0.3NA
难度: 中等查看答案及解析
-
已知 SO32ˉ+I2+H2O= SO42ˉ+2Iˉ+2H+,将 0.09molCl2通入 100mL 含 a molNaI与 a mol Na2SO4的混合溶液中,有 0.25a mol的 NaI 被氧化(不考虑 Cl2 与 I2 之间的反应),则下列说法正确的是
A.物质的还原性 Iˉ >SO32ˉ
B.NaI 与 Na2SO3 的物质的量浓度为 0.08mol/L
C.通入 0.09molCl2 发生反应的离子方程式为:8SO32ˉ+2Iˉ+9Cl2+8H2O=8SO42ˉ+I2+16H++18Clˉ
D.若再通入0.07molCl2,恰好能将 NaI与 Na2SO3 完全氧化
难度: 中等查看答案及解析
-
已知:Cu2O+H2SO4 = Cu+CuSO4 +H2O 。某红色粉末样品可能含有 Fe2O3 和 Cu2O 中的一种或两种,为探究其组成,取少量样品加入过量稀硫酸。下列有关说法正确的是
A.若固体全部溶解,则发生的离子反应只有:Fe2O3+6H+=2Fe3+ +3H2O
B.若固体部分溶解,则样品中一定含有 Cu2O,一定不含有 Fe2O3
C.若固体全部溶解,再滴加 KSCN 溶液,溶液不变红色,则样品中 n(Fe2O3):n(Cu2O)为 2:1
D.另取 ag 样品在空气中充分加热至质量不再变化,称其质量为 b g(b>a),则混合物中 Cu2O 的质量分数为 9(b-a)/a
难度: 困难查看答案及解析
-
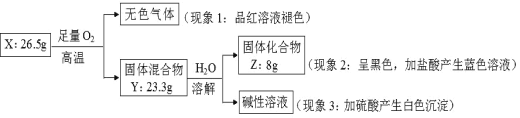
实验室以磷石膏(主要含CaSO4,还含少量SiO2、Fe2O3)为原料制取轻质 CaCO3,其实验流程如下:
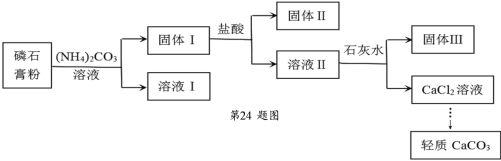
下列说法不正确的是
A.固体Ⅰ、固体Ⅱ中含有 SiO2,固体Ⅲ中含有 Fe(OH)3
B.由固体Ⅰ为原料制备 CaCl2 溶液使用的盐酸和石灰水均要过量
C.加入(NH4)2CO3 溶液的离子方程式为:CaSO4+CO32ˉ=CaCO3+SO42ˉ
D.检验固体Ⅰ洗涤是否完全,可取最后一次洗涤液往其中滴加盐酸酸化的 BaCl2 溶液,看有无沉淀生成
难度: 中等查看答案及解析
-
有一瓶澄清的溶液,只可能含有 NH4+、Na+、Mg2+、Ba2+、Fe3+、Clˉ、Brˉ、Iˉ、CO32ˉ、SO42—中的几种,且浓度均为 0.1mol L—1。进行以下实验:
①取少量溶液,滴加盐酸至溶液呈酸性,无明显现象。
②取少量溶液,滴加少许新制氯水,再加淀粉溶液,溶液变蓝
③取少量溶液,向其中逐滴加入 NaOH 溶液至碱性,过程中均无沉淀产生。将此溶液分为两等份,第一份加热,有气体放出;第二份溶液中加入Na2CO3 溶液,有白色沉淀生成。下列结论不正确的是
A.肯定含有的阳离子是 NH4+、Ba2+
B.肯定含有的阴离子是Iˉ、Clˉ、Brˉ
C.肯定不含有的离子是 Fe3+、CO32ˉ、SO42ˉ
D.不能确定是否含有的离子是 Na+
难度: 困难查看答案及解析