-
X、Y、Z、W为原子序数依次增大的短周期元素,它们位于两个主族。常温下,0.01mol∙L-1ZYX溶液的pH为12。下列相关说法正确的是( )
A.Z与W形成的化合物水溶液呈酸性
B.W的氧化物对应的水化物一定为强酸
C.由Y、Z、W三种元素形成的化合物不止两种
D.化合物X2Y、X2Y2中,Y不一定满足8电子结构
难度: 简单查看答案及解析
-
化学与生活密切相关。下列叙述错误的是
A.宋·陈鼓年《广韵》中有“酢浆也,醋也”,食醋的主要成分为乙酸
B.《诗经》有“周原膴膴,堇荼如饴(麦芽糖)”,麦芽糖属于单糖
C.食盐中抗结剂K4[Fe(CN)6]中的铁元素显+2价
D.碘伏是单质碘与聚乙烯吡咯烷酮的不定型结合物,可用于皮肤外用消毒
难度: 简单查看答案及解析
-
下列关于常见无机物的应用说法错误的是( )
A.用[Al2(OH)nCl6-n]m(碱式氯化铝)可除去水体中的悬浮杂质并消毒杀菌
B.铁粉和炭粉组成的微电池可用于处理工业废水
C.氨水可用于脱除工业烟气中的二氧化硫
D.将废铁屑加入氯化亚铁溶液中,可用于除去工业废气中的氯气
难度: 中等查看答案及解析
-
中国制造彰显中国力量,在电影《厉害了,我的国》中重点介绍了中国制造的重点工程,下列所涉及的材料不属于无机非金属材料的是( )

世界最大射电望远镜“中国天眼”

“嫦娥四号”月球探测器

中国大飞机C919

中国第一艘深海载人潜水器“蛟龙号”
A.光导纤维传输线
B.晶体硅芯片
C.新型铝锂合金机翼
D.氮化硅陶瓷发动机
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
常温下,下列各离子能在指定溶液中一定大量共存的是( )
A.使甲基橙变红的溶液:Fe2+、NO3-、SO42-、Na+
B.加入铝粉放出氢气的溶液:Na+、Cl-、NH4+、NO3-
C.水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+
D.
值为100的溶液:S2-、Na+、SO42-、SO32-
难度: 中等查看答案及解析
-
课堂学习中,同学们利用铝条、锌片、铜片、导线、电流计、橘子汁等物质来探究原电池的组成,下列结论不正确的是
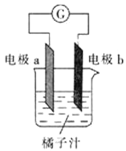
A.若a为铝片,b为锌片或铜片,则导线中一定产生电流
B.若a为锌片,b为铝片,则b极上的电极反应式为
C.原电池是将化学能转化为电能的装置
D.若a、b均为铝片,则电流计指针不偏转
难度: 简单查看答案及解析
-
设
为阿伏加德罗常数的数值,下列说法正确的是( )
A.100g 46%甘油水溶液中含—OH的数目为1.5NA
B.1.7g由NH3与13CH4组成的混合气体中含质子总数为NA
C.0.1mol∙L-1的Al2(SO4)3溶液中含Al3+的数目小于0.2 NA
D.反应CH4 + 2NO + O2 = CO2 + N2 + 2H2O,每消耗标准状况下22.4L NO,反应中转移的电子数目为2 NA
难度: 简单查看答案及解析
-
中国科技大学改进Pd/Al2O3催化H2还原CO2制备甲醇的生产工艺,其机理如图所示,下列说法不正确的是( )
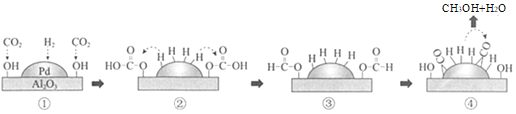
A.金属钯是优良的贮氢材料
B.①→②为CO2发生加成反应
C.④中CO被氧化为CH3OH
D.生成甲醇的总反应方程式是CO2+3H2
CH3OH+H2O
难度: 中等查看答案及解析
-
环丙烯基甲酰氯(甲)是合成查尔酮抑制剂的中间体,可由甲在一定条件下制备乙,下列相关叙述不正确的是( )
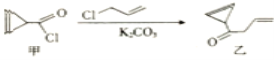
A.该反应属于取代反应
B.甲分子中的所有碳原子处于同一平面
C.丙是乙的同分异构体,丙可能属于芳香族化合物
D.甲和乙均能使溴水和酸性高锰酸钾溶液褪色
难度: 中等查看答案及解析
-
下列反应方程式中,能正确表达反应颜色变化的是( )
A.280K时,在一干燥密闭容器中充入NO2和SO2,产生白烟:NO2+SO2═NO+SO3
B.水玻璃敞口放置产生白色浑浊:SiO32-+H2O═SiO2↓+2OH-
C.银器久置空气中表面变黑:4Ag+O2═2Ag2O
D.沸水中滴入FeCl3溶液,液体变为红褐色:Fe3++3OH-═Fe(OH)3↓
难度: 中等查看答案及解析
-
甲烷与氧气反应过程中的能量变化如图所示。下列有关说法中正确的是( )
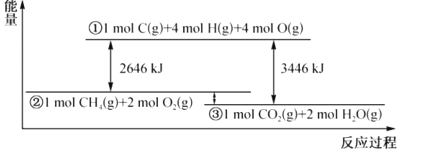
A.CH4(g)的能量大于CO2(g)和H2O(g)的能量总和
B.反应CH4(g)+2O2(g)═CO2(g)+2H2O(l) △H=-800kJ•mol-1
C.在反应CH4(g)+2O2(g)═CO2(g)+2H2O(g) 中,放出热量400kJ,有1mol O-H键生成
D.若破坏1molO2(g)中的化学键需吸收热量493kJ,则破坏1mol C-H键需吸收热量415kJ
难度: 中等查看答案及解析
-
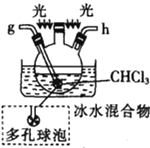
氯气氧化HBr提取溴的新工艺反应之一为:6H2SO4+5BaBr2+Ba(BrO3)2=6BaSO4↓+6Br2+6H2O,利用此反应和CCl4得到液溴的实验中不需要用到的实验装置是
A.
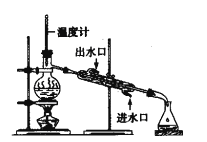
B.
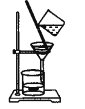
C.
D.
难度: 中等查看答案及解析
-
用H2消除酸性废水中的NO2-是一种常 用的电化学方法。其反应原理如图所示,下列说法不正确的是( )
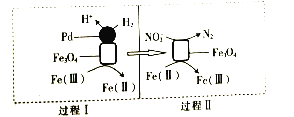
A.Fe3O4在该反应中作催化剂
B.Pd上发生的反应为H2-2e-═2H+
C.总反应为3H2+2NO2-═N2+2OH-+2H2O
D.Fe(Ⅱ)与Fe(Ⅲ)之间相互转化起到了传递电子的作用
难度: 中等查看答案及解析
-
25℃时,往二元弱酸的钠盐Na2A溶液中通入HCl,溶液中-lg
和-lgc(A2-)的关系如图所示。下列说法正确的是( )
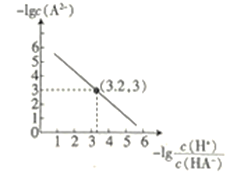
A.K(HA-)的数量级为10-7
B.通入HCl的过程中,水电离出的c(H+)不断增大
C.在Na2A溶液中:c(OH-)= c(H2A)+ c(HA-)+ c(H+)
D.当通入的HCl的物质的量与Na2A的物质的量相等时c(Na+)+ c(H+)= c(HA-)+2 c(A2-)+ c(OH-)
难度: 中等查看答案及解析
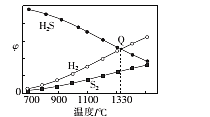

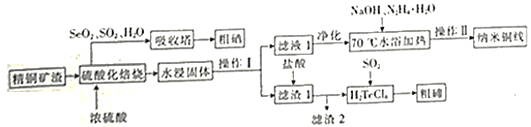
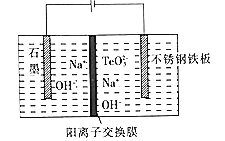
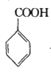 +COCl2
+COCl2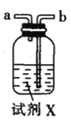 乙.
乙. 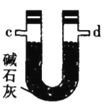 丙.
丙. 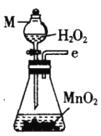 丁.
丁.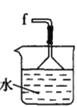 戊.
戊.