-
某兴趣小组的同学设计实验制备并探究SO2的性质。回答下列问题:
(1)实验室用废铜屑制备SO2的化学方程式为______。
(2)将SO2通入NaHS溶液,溶液中有淡黄色沉淀,说明SO2具有______性。
(3)将SO2通过品红溶液,溶液红色逐渐褪去,将褪色后的溶液微热,又显浅红色,这现象可解释为______。
(4)将SO2通入橙黄色酸性K2Cr2O7溶液,溶液逐渐变为浅绿色,该反应中氧化剂与还原剂的物质的量之比为______。(Cr2O72-被还原为Cr3+)
(5)常温下,改变0.1mol•L-1H2SO3溶液(SO2水溶液)的pH,溶液中的H2SO3、HSO3-、SO32-的物质的量分数δ(X)[δ(X)=  ]随pH的变化如图所示:
]随pH的变化如图所示:
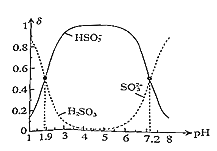
H2SO3的lgKa1=______;反应HSO3-+OH- SO32-+H2O的lgK=______;用0.100mol•L-1NaOH溶液滴入0.100mol•L-1H2SO3溶液(甲基橙作指示剂)中,溶液由红色变为橙色时,发生的主要反应的离子方程式为______。
SO32-+H2O的lgK=______;用0.100mol•L-1NaOH溶液滴入0.100mol•L-1H2SO3溶液(甲基橙作指示剂)中,溶液由红色变为橙色时,发生的主要反应的离子方程式为______。
-
某校化学实验兴趣小组为了探究在实验室制备 Cl2 的过程中有水蒸气和 HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置 ( 支撑用的铁架台省略 ),按要求回答问题.
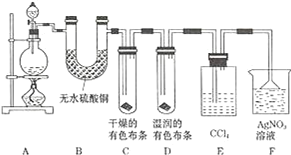
(1)下列方法中,可制得氯气的正确组合是___.(已知酸性条件下,K2Cr2O7、KClO3的氧化性均强于Cl2;酒精灯可以不用)
①MnO2 和浓盐酸混合共热; ②次氯酸钠和浓盐酸混合;③K2Cr2O7 和浓盐酸混合; ④KClO3 和浓盐酸混合共热;⑤KMnO4和浓盐酸混合;
A 只有① B 只有①⑤ C 只有①③④⑤ D 全部可以
(2)若用含有 0.2mol HCl 的浓盐酸与足量的 MnO2 反应制 Cl2,制得的 Cl2 体积 ( 标准状况下 )总是小于1.12L的原因是___.
(3)装置 B 的作用____,现象是____.
(4)装置 C 和 D 出现的不同现象说明的问题是___、装置 E 的作用是____.
(5)写出装置 F 中发生反应的离子方程式____.
(6)乙同学认为甲同学的实验有缺陷,不能确保最终通入 AgNO3 溶液中的气体只有一种.为了确保实验结论的可靠性,证明最终通入 AgNO3 溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置.你认为该装置应加在__与__之间 ( 填装置字母序号 ),装置中应放入___.
-
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题。
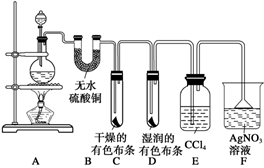
(1)下列方法中,可制得氯气的正确组合是________。
①MnO2和浓盐酸混合共热
②KMnO4和浓盐酸混合 ③氯酸钠和浓盐酸混合 ④K2Cr2O7和浓盐酸混合
A.①②③ B.①②④ C.①② D.全部可以
(2)若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制取Cl2,制得的Cl2体积(标准状况下)总是小于1.12 L的原因是。
(3)①装置B的作用是________,现象是________。
②装置C和D出现的不同现象说明的问题是________。
③装置E的作用是________
目前我国饮用水消毒主要用氯——通氯气,加漂白粉或漂白精。
(1) 漂白粉或漂白精长期放置于空气中会变质失效,其化学方程式是__________________。
(2)目前我国广泛采用经过干燥空气稀释的氯气,通入填有固体亚氯酸钠(NaClO2)的柱内
制得ClO2,这一反应的化学方程式是:_________________________________________。
-
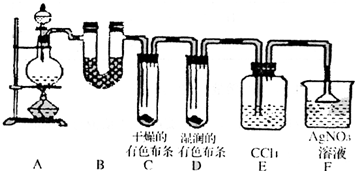
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题.
(1)下列方法中,可制得氯气的正确组合是______.
①MnO2和浓盐酸混合共热②MnO2、NaCl和浓硫酸混合共热
③次氯酸钠和浓盐酸混合④K2Cr2O7和浓盐酸混合
⑤KClO3和浓盐酸混合共热⑥KMnO4和浓盐酸混合
A.①②⑥;B.②④⑥;C.①④⑥;D.全部可以
(2)若用含有0.2mol HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积(标准状况下)总是小于1.12L的原因是______
(3)①装置B的作用是______,现象是______.
②装置C和D出现的不同现象说明的问题是______.
③装置E的作用是______.
④写出装置F中发生反应的离子方程式______.
(4)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种.为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置.你认为该装置应加在______与______之间(填装置字母序号),装置中应放入______.
-
(20分)某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题:
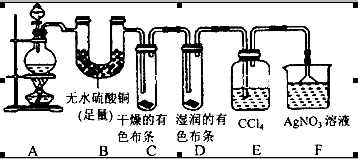
(1)下列方法中,可制得的正确组合是__________。
①MnO2和浓盐酸混合共热; ②MnO2、NaCl和浓硫酸混合共热:
③NaClO和浓盐酸混合; ④K2Cr2O7和浓盐酸混合:
⑤KClO3和浓盐酸混合共热; ⑥KMnO4和浓盐酸混合。
A.①②⑥B.②④⑥C.①④⑥ D.全部可以
(2)写出实验室制取Cl2的离子方程式____________。
(3)若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制得Cl2的体积(标况下)总是小于1.12L的原因是_________________________________________。
(4)①装置B的作用是__________________________________。
②装置C和D出现的不同现象说明的问题是________________________。
③装置E的作用是_____________________。
(5)乙同学认为甲同学的实验有缺陷,不能确像最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出应该在装置__________与________之间(填装置字母序号)增加一个装置,增加装置里面的试剂可为____________。
A.湿润的淀粉KI试纸B.氢氧化钠溶液
C.湿润的红色布条 D.饱和的食盐水
-
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题:
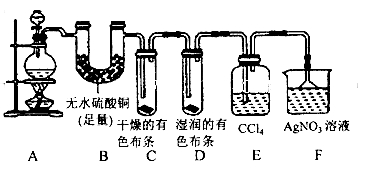
(1)下列方法中,可制得的正确组合是__________。
①MnO2和浓盐酸混合共热;②MnO2、NaCl和浓硫酸混合共热:
③NaClO和浓盐酸混合;④K2Cr2O7和浓盐酸混合:
⑤KClO3和浓盐酸混合共热;⑥KMnO4和浓盐酸混合。
A.①②⑥ B.②④⑥ C.①④⑥ D.全部可以
(2)写出实验室制取Cl2的离子方程式____________。
(3)若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制得Cl2的体积(标况下)总是小于1.12L的原因是__________________________。
(4)①装置B的作用是__________________。
②装置C和D出现的不同现象说明的问题是_______________。
③装置E的作用是_____________________。
(5)乙同学认为甲同学的实验有缺陷,不能确定最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出应该在装置__________与________之间(填装置字母序号)增加一个装置,增加装置里面的试剂可为____________。
A.湿润的淀粉KI试纸 B.氢氧化钠溶液
C.湿润的红色布条 D.饱和的食盐水
-
(10分)某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.
(1)若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积(标准状况下)总是小于1.12 L的原因是___________________________________________.
(2)①装置B中盛放的试剂名称为________________,作用是____________________________,
现象是____________________________________________________________.
②装置D和E中出现的不同现象说明的问题是_________________________________
③装置F的作用是________________________________________________________.
④写出装置G中发生反应的离子方程式______________________________________
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种.为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置.你认为该装置应加在________与________之间(填装置字母序号),装置中应放入________(填写试剂或用品名称).
-
某化学兴趣小组设计如下实验方案,将浓硫酸与铜片反应制备SO2并进行相关实验探究,实验装置如图所示:
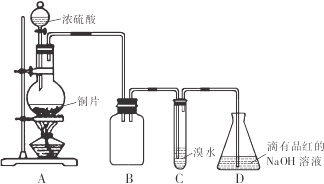
请回答下列问题:
(1)装置B的作用是______。
(2)设计装置C的目的是验证SO2的______性,装置C中发生反应的离子方程式是______装置D中NaOH全部转化为NaHSO3的标志是______。
(3)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能的情况:
I.HSO3-与ClO-恰好反应
Ⅱ.NaClO不足
Ⅲ.NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请完成下表:(已知酸性:H2SO3>H2CO3>HClO)
| 序号 | 实验操作 | 现象 | 结论 |
| ① | 加几小块CaCO3固体 | 有气泡产生 | I或Ⅱ |
| ② | 滴加少量淀粉KI溶液,振荡 | _______ | Ⅲ |
| ③ | 滴加少量溴水,振荡 | _________ | Ⅱ |
| ④ | 滴加少量酸性KMnO4溶液、振荡 | 溶液为紫色 | ____ |
(4)请设计简单实验证明:室温下HSO3-的电离平衡常数Ka与水解平衡常数Kb,的相对大小:___。
-
化学是一门以实验为基础的学科,实验探究能激发学生学习化学的兴趣。某化学兴趣小组设计如图实验装置(夹持设备已略)制备氯气并探究氯气及其卤族元素的性质。回答下列问题:
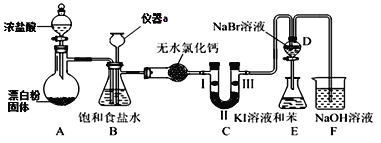
(1)仪器a的名称是______________。
(2)A装置中发生的化学反应方程式为_________________________________。若将漂白粉换成KClO3,则反应中每生成21.3g Cl2时转移的电子数目为____NA。
(3)装置B可用于监测实验过程中C处是否堵塞,若C处发生了堵塞,则B中可观察到__________。
(4)装置C的实验目的是验证氯气是否具有漂白性,此时C中Ⅰ、Ⅱ、Ⅲ依次可放入____(填选项a或b或c)。
| 选项 | Ⅰ | Ⅱ | Ⅲ |
| a | 干燥的有色布条 | 浓硫酸 | 湿润的有色布条 |
| b | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
| c | 湿润的有色布条 | 碱石灰 | 干燥的有色布条 |
(5)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入足量氯气时,可观察到无色溶液逐渐变为红棕色,说明氯的非金属性大于溴,打开活塞,将D中少量溶液加入E中,振荡E,观察到的现象是_______________________________,该现象_____(填“能”或“不能”)说明溴的非金属性强于碘,原因是_____________________。
-
化学是一门以实验为基础的学科,实验探究能激发学生学习化学的兴趣。某化学兴趣小组设计如图实验装置(夹持设备已略)制备氯气并探究氯气及其卤族元素的性质。回答下列问题:
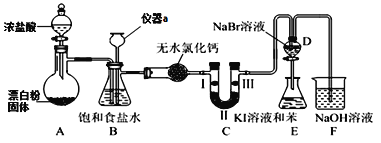
(1)仪器a的名称是______________。
(2)A装置中发生的化学反应方程式为_________________________________。若将漂白粉换成KClO3,则反应中每生成21.3g Cl2时转移的电子数目为____NA。
(3)装置B可用于监测实验过程中C处是否堵塞,若C处发生了堵塞,则B中可观察到__________。
(4)装置C的实验目的是验证氯气是否具有漂白性,此时C中Ⅰ、Ⅱ、Ⅲ依次可放入____(填选项a或b或c)。
| 选项 | Ⅰ | Ⅱ | Ⅲ |
| a | 干燥的有色布条 | 浓硫酸 | 湿润的有色布条 |
| b | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
| c | 湿润的有色布条 | 碱石灰 | 干燥的有色布条 |
(5)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入足量氯气时,可观察到无色溶液逐渐变为红棕色,说明氯的非金属性大于溴,打开活塞,将D中少量溶液加入E中,振荡E,观察到的现象是_______________________________,该现象_____(填“能”或“不能”)说明溴的非金属性强于碘,原因是_____________________。
]随pH的变化如图所示:

SO32-+H2O的lgK=______;用0.100mol•L-1NaOH溶液滴入0.100mol•L-1H2SO3溶液(甲基橙作指示剂)中,溶液由红色变为橙色时,发生的主要反应的离子方程式为______。







