-
化学与人类生活、生产和社会可持续发展密切相关,下列说法错误的是
A.84消毒液具有强氧化性,可用于居家环境杀菌消毒
B.加强生活垃圾分类与再生资源回收有利于践行“绿水青山就是金山银山”的理念
C.中国华为自主研发的5G芯片巴龙5000的主要材料是Si
D.太阳能光催化环境技术技术可以将二氧化碳转化为燃料,该燃料属于一次能源
难度: 中等查看答案及解析
-
从杨树中提取的Z是具有美白功效的化妆品的组分。现可用如下反应制备:
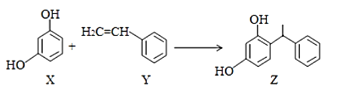
下列叙述错误的是
A.上述X+Y→Z反应属于加成反应
B.Z在苯环上的一氯代物有8种
C.Z所有碳原子不可能处于同一平面
D.Y可作为加聚反应的单体
难度: 中等查看答案及解析
-
实验室常用乙醇和浓硫酸共热制取乙烯:CH3CH2OH
H2C=CH2↑+H2O某同学用以下装置进行乙烯制取实验。下列叙述不正确的是
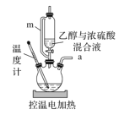
A.m的作用是确保乙醇与浓硫酸能顺利流下
B.电控温值可设置在165-175℃
C.a出来的气体可用瓶口向下排空气法收集
D.烧瓶内可放几粒碎瓷片以防暴沸
难度: 中等查看答案及解析
-
生物固氮与模拟生物固氮都是重大基础性研究课题。大连理工大学曲景平教授团队设计合成了一类新型邻苯二硫酚桥联双核铁配合物,建立了双铁分子仿生化学固氮新的功能分子模型。如图是所发论文插图。以下说法错误的是
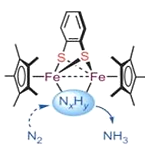
A.催化剂不能改变反应的焓变
B.催化剂不能改变反应的活化能
C.图中反应中间体NXHY数值X<3
D.图示催化剂分子中包含配位键
难度: 中等查看答案及解析
-
某可充电钠离子电池放电时工作原理如图所示,下列说法错误的是
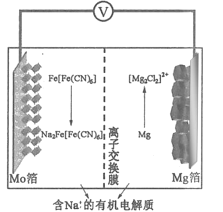
A.放电时电势较低的电极反应式为:Fe[Fe(CN)6]+2Na++2e-=Na2Fe[(CN)6]
B.外电路中通过0.2 mol电子的电量时,负极质量变化为2.4 g
C.充电时,Mo箔接电源的正极
D.放电时,Na+从右室移向左室
难度: 中等查看答案及解析
-
某抗癌药物的结构简式如图所示,其中W、X、Y、Z是原子序数依次增大的短周期主族元素,W、Y同主族,Y、Z的最外层电子数之和是X的最外层电子数的2倍。下列叙述正确的是
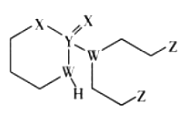
A.元素的非金属性:W>Z>X
B.Y的最高价氧化物的水化物是强酸
C.W的最简单氢化物与Z的单质混合后可产生白烟
D.Y、Z形成的化合物中,每个原子均满足8电子结构
难度: 中等查看答案及解析
-
利用pH传感器探究NaOH溶液与硫酸、硫酸铜混合溶液发生反应的离子反应顺序,绘得三份曲线图如图。已知实验使用的NaOH溶液浓度和滴速相同;硫酸溶液和硫酸铜溶液浓度相同;混合溶液中两溶质的浓度也相同。
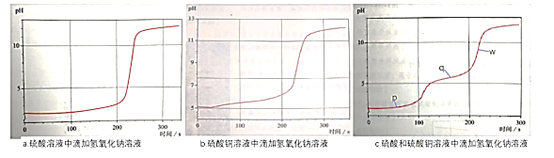
以下解读错误的是
A.三个时点的c(Cu2+):p>q>w
B.w点:c(Na+)>c(SO42-)>c(Cu2+)>c(H+)
C.混合溶液中滴加NaOH溶液,硫酸先于硫酸铜发生反应
D.q点时溶液离子浓度:c(SO42-)+c(OH-)=c(Cu2+)+c(H+)+c(Na+)
难度: 中等查看答案及解析

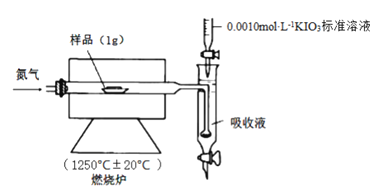

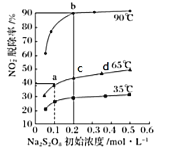
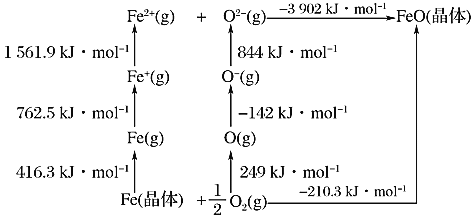


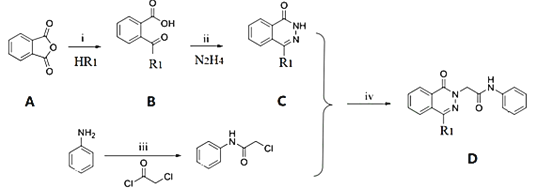
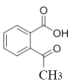 的同分异构体共有_____种,写出其中一种的结构简式: _______
的同分异构体共有_____种,写出其中一种的结构简式: _______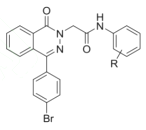 是一种高效低毒的抗肿瘤药物,请写出以
是一种高效低毒的抗肿瘤药物,请写出以 和
和 为原料制备该化合物的合成路线流程图(无机试剂任用):______________。
为原料制备该化合物的合成路线流程图(无机试剂任用):______________。