-
下列物质制造或使用过程中没有发生化学变化的是( )
A
B
C
D




明矾做净水剂
丙烯制造聚丙烯熔喷布
氨气制造液氨冷却剂
含碳酸氢钠的抗酸药治疗胃酸过多
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列化学用语的表述正确的是( )
A.
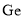 原子的价电子构型:
原子的价电子构型: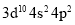
B.二氧化碳分子的比例模型:

C.
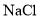 溶液导电:
溶液导电: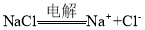
D.
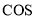 的电子式:
的电子式: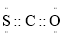
难度: 中等查看答案及解析
-
以下过程在常温下都可以自发进行,可用焓判据来解释的是
A.硝酸铵自发地溶于水
B.湿的衣服经过晾晒变干
C.2N2O5(g)=4NO2(g)+O2(g) ΔH = + 56.7 kJ/mol
D.2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/mol
难度: 中等查看答案及解析
-
下列颜色变化与氧化还原无关的是
A.湿润的红色布条遇到氯气褪色
B.棕黄色的FeCl3饱和溶液滴入沸水中变红褐色
C.紫色酸性KMnO4溶液通入乙烯气体后褪色
D.浅黄色Na2O2固体露置于空气中逐渐变为白色
难度: 简单查看答案及解析
-
从结构角度分析,下列说法错误的是( )
A.
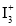 的立体构型为V形,中心原子的杂化方式为
的立体构型为V形,中心原子的杂化方式为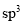
B.
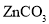 中,阴离子立体构型为平面三角形,C原子的杂化方式为
中,阴离子立体构型为平面三角形,C原子的杂化方式为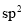
C.因
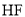 分子间存在氢键,所以
分子间存在氢键,所以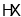 中其沸点最高
中其沸点最高D.因金属性
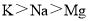 ,所以熔点:
,所以熔点: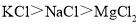
难度: 困难查看答案及解析
-
下列方程式正确的是( )
A.饱和
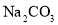 溶液与
溶液与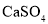 固体反应:
固体反应: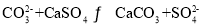
B.酸化
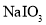 和
和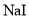 的混合溶液:
的混合溶液: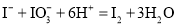
C.
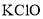 碱性溶液与
碱性溶液与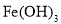 反应:
反应: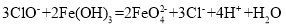
D.电解熔融
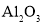 的阳极反应:
的阳极反应: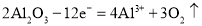
难度: 中等查看答案及解析
-
科学家从某中草药提取的有机物结构如下图所示。下列说法正确的是
A.分子式为C14H10O6
B.环上氢原子被取代,所得一氯代物有3种
C.1mol该有机物与足量NaOH溶液反应最多消耗4mol NaOH
D.该有机物的熔点可能比同碳原子的烃分子熔点高
难度: 中等查看答案及解析
-
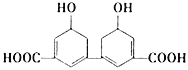
下列有关实验装置或操作正确的是
A. 装置甲液面读数为12.20 mL B. 装置乙可探究铁的吸氧腐蚀
C. 装置丙可检验乙烯的生成 D. 装置丁可验证碳酸氢钠受热分解
难度: 中等查看答案及解析
-
根据下图实验所得推论不合理的是( )
已知:苯酚的熔点为43℃
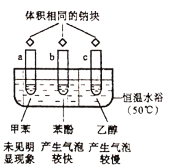
A.试管a中钠沉在底部,说明密度:甲苯<钠
B.试管b、c中生成的气体均有
C.苯酚中羟基的活性比乙醇中羟基的活性强
D.羟基对苯环的影响使苯环上羟基邻、对位的
 键易于断裂
键易于断裂难度: 中等查看答案及解析
-
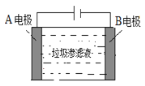
利用偏铝酸钠(NaA1O2)溶液电解法制备氢氧化铝的简易装置如图所示,其中两电极均为惰性电极。下列说法正确的是( )
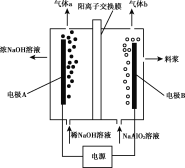
A.电极A为阳极
B.气体b为H2
C.所得料浆液的pH大于原料NaA1O2溶液的pH
D.该方法总反应方程式是:4NaA1O2+10H2O
 4A1(OH)3+4NaOH+O2↑+2H2↑
4A1(OH)3+4NaOH+O2↑+2H2↑难度: 中等查看答案及解析
-
25℃时,向
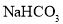 溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )
溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )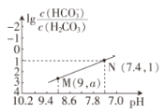
A.N点溶液可由等体积等浓度的
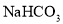 、
、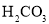 溶液混合而成
溶液混合而成B.25℃时,
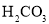 的一级电离
的一级电离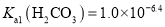
C.图中
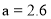
D.25℃时,
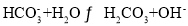 的
的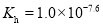
难度: 困难查看答案及解析
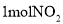 ,发生反应:
,发生反应: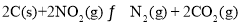 反应相同时间,测得各容器中
反应相同时间,测得各容器中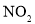 的转化率与容器体积的关系如图所示。下列说法正确的是( )
的转化率与容器体积的关系如图所示。下列说法正确的是( )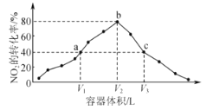
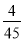
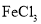 是一种常用的净水剂,氯元素的原子核外有_____种不同运动状态的电子:有_____种不同能量的电子。
是一种常用的净水剂,氯元素的原子核外有_____种不同运动状态的电子:有_____种不同能量的电子。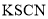 或
或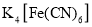 来检验
来检验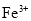 。
。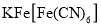 ,该物质晶胞的
,该物质晶胞的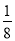 结构如图所示(
结构如图所示(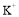 未画出)则一个晶胞中的
未画出)则一个晶胞中的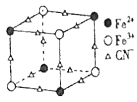
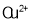 能与乙二胺
能与乙二胺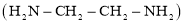 形成配离子。该配离子中含有的化学键类型有________(填字母): a.配位键 b.极性键 c.离子键 d.非极性键
形成配离子。该配离子中含有的化学键类型有________(填字母): a.配位键 b.极性键 c.离子键 d.非极性键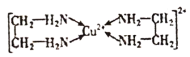
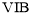 族元素,化合价可以是
族元素,化合价可以是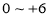 的整数价态。回答下列问题,某化合物的化学式为
的整数价态。回答下列问题,某化合物的化学式为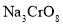 ,其阴离子结构可表示为
,其阴离子结构可表示为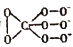 ,则Cr的化合价为_________。
,则Cr的化合价为_________。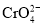 呈四面体构型,结构为
呈四面体构型,结构为 ,
,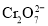 由两个
由两个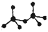 。则由
。则由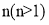 个
个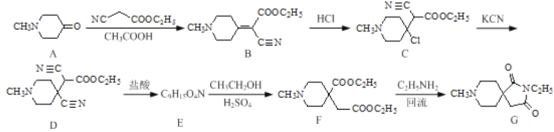
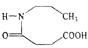 和乙醇为原料制备
和乙醇为原料制备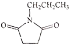 的合成路线(无机试剂任用)__________。
的合成路线(无机试剂任用)__________。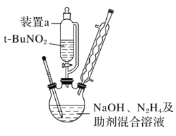
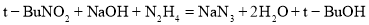 。
。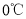 下冷却至有大量晶体析出后过滤。所得晶体使用_______洗涤;
下冷却至有大量晶体析出后过滤。所得晶体使用_______洗涤;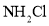 、
、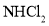 和
和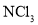 )
)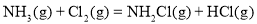
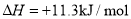
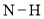
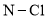
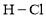
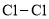
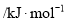
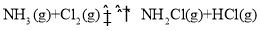 达到平衡,通过热力学定律计算,不同温度下理论上
达到平衡,通过热力学定律计算,不同温度下理论上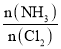 的变化如下图所示。
的变化如下图所示。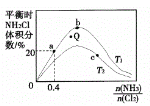
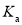 、
、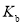 、
、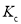 表示)_______;b点时,该反应的平衡常数为________;
表示)_______;b点时,该反应的平衡常数为________;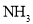 的转化率的方法是______(任写一种);
的转化率的方法是______(任写一种);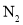 。
。