-
下列说法中正确的是
A. “冰、水为之,而寒于水”说明相同质量的冰和水比较,冰的能量更高
B. “蜡炬成灰泪始干”中“泪”的主要成分是水
C. “南朝四百八十寺。多少楼台烟雨中”的“烟雨”是由飘浮在空气中的固体小颗粒形成的
D. “钻石恒久远,一颗水流传”说明常温下钻石的化学性质比较稳定
难度: 简单查看答案及解析
-
下列各组中的物质,均能发生加成反应的是
A. 溴苯和植物油 B. 苯和环已烷 C. 乙烯和乙烷 D. 乙醇和乙酸
难度: 简单查看答案及解析
-
NaCN(氰化钠)有毒,是一种重要的基础化工原料,可用于化学合成、电镀、冶金等。下列说法不正确的是
A. NaCN中含有的化学键类型为离子键和极性键
B. NaCN 中碳元素显+4 价
C. NaCN 与过量过氧化氢反应时有NH3生成,在该反应中,NH3既不是氧化产物又不是还原产物
D. 实验室配制NaCN 溶液时,先将NaCN 固体溶解在较浓的NaOH 溶液中,再加水稀释
难度: 中等查看答案及解析
-
下列有关仪器的使用方法或实验操作正确的是
A. 使用容量瓶和分液漏斗前必须检漏
B. 可以用温度计代替玻璃棒搅拌溶液
C. 进行中和滴定实验时,需用待测液润洗锥形瓶
D. 熔化氢氧化钠固体需在玻璃坩埚中进行
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值。下列说法中不正确的是
A. 44g由N2O 和CO2 组成的混合气体中所含的原子总数为3NA
B. 标准状况下,22.4 L.乙烷和22.4L苯所含C-H键的数目均为6NA
C. 2.8g由CO和C2H4 组成的混合气体中所含的分子总数为0.1NA
D. 1L0.1mol·L-1CH3COOH溶液中,CH3COOH和CH3COO-的数目之和为0.1NA
难度: 中等查看答案及解析
-
化学在生活中有着广泛的应用,下列对立关系正确的是
选项
化学性质
实际应用
A
SO2具有还原性
漂白纸浆
B
HF具有弱酸性
在玻璃上刻字,
C
铝的金属活动性强于氢
用铝制容器贮运浓硝酸
D
FeCl3溶液能与Cu反应
蚀刻铜箔制造电路板
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
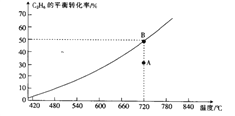
2017 年5月4 日《光明日报》报道称,中科院大连化学物理研究所的研究团队利用多功能催化剂首次实现了CO2直接加氢制汽油的过程。其转化过程如图所示:
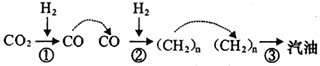
下列说法正确的是
A. 反应①的产物中含有水。
B. 反应②为化合反应
C. 所制得汽油的主要成分是烃和烃的含氧衍生物
D. 这种人造汽油用作汽车的燃料时,汽车尾气中不含氮氧化物
难度: 中等查看答案及解析
-
交通运输部在南海华阳礁举行华阳灯塔和赤瓜灯塔竣工发光仪式,宣布两座大型多功能灯塔正式发光并投入使用。镁海水电池可为灯塔提供能源,其装置如图所示。下列有关镁海水电池的说法正确的是
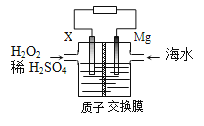
A. Mg电极上发生还原反应
B. 该电池工作一段时间后,左侧溶液质量减轻
C. 正极的电极反应式为H2O2+2e-+2H+=2H2O
D. 若电池工作时转移2mol 电子,则有2molH+由质子交换膜左侧向右侧迁移
难度: 中等查看答案及解析
-
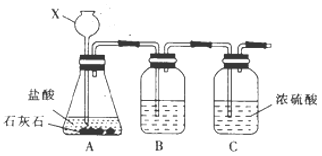
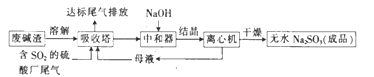
Cl2O是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物或还原剂接触会发生燃烧并爆炸。一种制取Cl2O的装置如图所示。
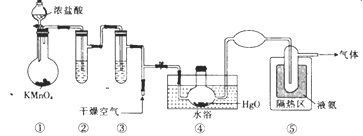
已知:Cl2O的熔点为-116℃,沸点为3.8 ℃;Cl2的沸点为-34.6℃;HgO+2Cl2=HgCl2+Cl2O。下列说法正确的是
A. 装置②、③中盛装的试剂依次是浓硫酸和饱和食盐水
B. 通干燥空气的目的是作氧化剂
C. 从装置⑤中逸出气体的主要成分是Cl2O
D. 装置④与⑤之间不用橡皮管连接,是为了防止橡皮管燃烧和爆炸
难度: 中等查看答案及解析
-
满足下列条件的有机物的种类数正确的是
选项
有机物
条件
种类数
A
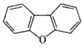
该有机物的一氯代物
4
B
C6H12O2
能与NaHCO3溶液反应
3
C
C5H12O
含有2个甲基的醇
5
D
C5H10O2
在酸性条件下会水解生成甲和乙,且甲、乙的相对分子质量相等
4
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
W、X、Y、Z为原子序数依次增大的短周期主族元素。W的原子半径是周期表中最小的;X2-与Y+的电子层结构相同;Z的最高正价与最低负价的代数和为4。下列说法正确的是
A. 原子半径:Z<Y<X
B. 最简单氢化物的稳定性:X<Z
C. 由W、X、Y三种元素形成的化合物可使酚酞试液变红
D. Y与Z位于同一周期,且它们在自然界中均能以游离态的形式存在
难度: 中等查看答案及解析
-
下列实验对应的现象以及结论均正确的是
选项
实验
现象
结论
A
向装有溴水的分液漏斗中加入裂化汽油,充分振荡,静罝
下层为橙色
裂化汽油可萃取溴
B
向Ba(ClO)2溶液中通入SO2
有白色沉淀生成
酸性:H2SO3>HClO
C
将钠块加入盛有无水乙醇的烧杯中
有气泡产生
生成的气体是H2
D
分别向相同浓度的ZnSO4溶液和CuSO4溶液中通入H2S
前者无现象,后者有黑色沉淀生成
Ksp(ZnS)<Ksp(CuS)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
常温下,0.1mol·L-1的H2A溶液中各种微粒浓度的对数值(lgc)与pH的关系如图所示。
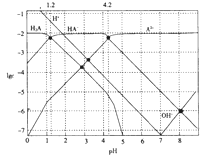
下列说法不正确的是
A. H2A是二元弱酸
B. HA-
H++A2-的电离平衡常数Ka=10-12
C. 0.1mol·L-1的H2A溶液中:c(H+)=c(HA-)+2c(A2-)+c(OH-)
D. pH=4.2 时:c(HA-)=c(A2-)>c(H+)>c(H2A)>c(OH-)
难度: 中等查看答案及解析