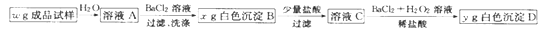-
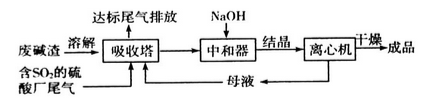
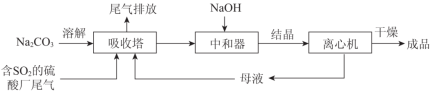
利用废碱渣(主要成分为Na2CO3)处理硫酸厂尾气中的SO2,可制得无水Na2SO3(成品),其流程如图所示。
(1)某硫酸厂排放出的尾气中SO2 的含量特别高,而废碱渣的量不足,此时“吸收塔”内发生反应的离子方程式为____________(不考虑H2O与SO2 反应)。
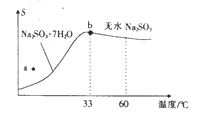
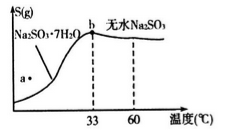
(2)亚硫酸钠的溶解度曲线如图所示,则上述流程中“结晶”的方法是__________(填“蒸发结晶”或“降温结晶”),图中a点所示分散系类别为_____________________(填“ 浊液”“ 胶体”或“溶液”)。
(3)仅用BaCl2,H2O2 和过量稀盐酸的混合溶液难以检出“成品”中的SO32-,原因是“成品”中含有某种杂质阴离子。
①该杂质阴离子为_______(填离子符号)。
②25℃时,部分钡盐的Ksp如下表所示。
| 化学式 | BaSO4 | BaSO3 |
| Ksp | 1.1×10-10 | 5.5×10-7 |
将得到的“成品”溶于水,测得溶液中SO32-的浓度为0.5 mol·L-1 ,为杂质阴离子浓度的10 倍,向该溶液中加入等体积.0.5 mol·L-1 的BaCl2 溶液,充分反应后c(Ba2+)=_____ mol·L-1 。(混合时溶液体积的变化忽略不计)
(4)某同学采用如下方法检验SO32-;
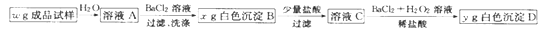
①洗涤时使用的试剂最好为_______(填字母)。
a.稀HNO3 b.蒸馏水 C.稀H2SO4
②根据上述流程中的数据(w、x、y),_______(填“能”或“不能”)计算出成品试样中SO32-的百分含量,若能,则SO32- 的百分含量为_______(若不能,则此空不填);若不能,则理由是_______________(若能,则此空不填)。
-
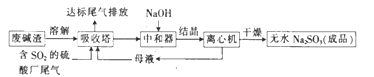
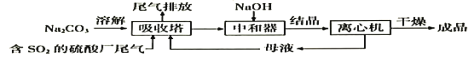
利用废碱渣(主要成分是Na2CO3)处理硫酸厂尾气中的SO2可制得无水Na2SO3(成品),其流程如下:
(1)若欲利用废碱渣充分吸收SO2,则“吸收塔”内发生的主要反应的离子方程式为___________________。
(2)处理过程中,要通过检验“吸收塔”排放出的尾气是否含有SO2来确定其是否达标。实验室中欲模拟检验尾气中的SO2,可以选用的试剂有___________________;
a.澄清石灰水 b.硝酸酸化的Ba(NO3)2溶液 c.盐酸酸化的BaCl2溶液 d.品红溶液
(3)常温下,向“中和器”中加入适量NaOH后,溶液呈中性,则溶液中c(SO32-):c(HSO3-)=_____[已知:常温下,Ka1(H2SO3) = l. 5×10-2,Ka2(H2SO3) =6.3×10-8];
(4)下图所示为亚硫酸钠的溶解度曲线,则上述流程中的“结晶”方法是____________(填“蒸发结晶”或“降温结晶”),图中a点所示分散系类别为_________________;
(5)仅用BaCl2和H2O2的混合溶液难以检出“成品"中的SO32-,原因是“成品”中含有某种杂质阴离子,该杂质阴离子_____________(填化学式);实验室中常用如下方法检验SO32-:

己知25℃时,部分钡盐的数值如下表:
| BaCO3 | BaSO4 | BaSO3 | BaS2O3 |
| 5.1×10-9 | 1.1×10-10 | 8.4×10-7 | 1.6×10-5 |
若“溶液A”中SO32-浓度为0.01 mol·L-1,且为杂质阴离子浓度的10倍,则向其中加入等体积0.01 mol • L-1BaCl2溶液充分反应后c(Ba2+)=________mol·L-1,向 “溶液B”中滴入BaCl2和H2O2的混合溶液时,发生反应的离子方程式为______________。
-
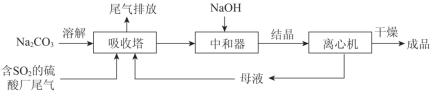
低浓度SO2废气的处理是工业难题,工业上常利用废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的成本低,优势明显,其流程如下。

(1)为了使SO2尽可能吸收完全,在不改变吸收塔体积的条件下,可以采取的合
理措施______________、_______________。(写出两条)
(2)中和器中发生的主要反应的离子方程式是_____________________。
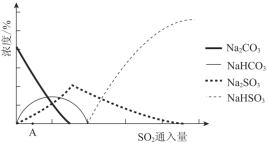
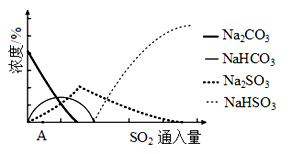
(3)下图为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化。
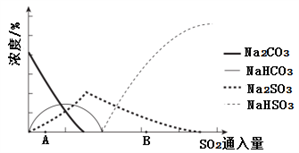
①则初期反应(图中A点以前)的化学方程式是__________________。
②通过电解法可分离图中B点NaHSO3与Na2SO3混合物,实现Na2SO3的循环利用,示意图如下:
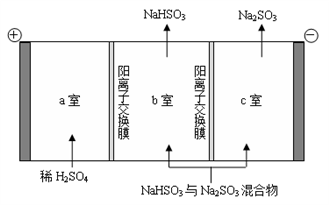
简述分离NaHSO3与Na2SO3混合物的原理___________________。
(4)下图是亚硫酸钠的溶解度曲线(温度在33℃前后对应不同物质),下列说法正确的是______
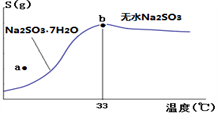
A.a点时溶液为不饱和溶液
B.b点时Na2SO3·7H2O和无水Na2SO3共存
C.制备无水Na2SO3,应该在95~100℃加热浓缩,冷却至室温结晶
(5)如果用含等物质的量溶质的下列各溶液分别吸收SO2,则理论吸收量最多的是__________
A.Na2SO3 B.Na2S C.Ba(NO3)2 D.酸性KMnO4
-
Na2SO3应用广泛。利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的成本低,优势明显,其流程如下。
(1)举例说明向大气中排放SO2导致的环境问题:_________。
(2)下图为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化。则初期反应(图中A点以前)的离子方程式是_________。
(3)中和器中发生的主要反应的化学方程式是_________。
| 资料显示: Ⅰ.Na2SO3在33℃时溶解度最大,将其饱和溶液加热至33℃以上时,由于溶解度降低会析出无水Na2SO3,冷却至33℃以下时析出Na2SO3·7H2O; Ⅱ.无水Na2SO3在空气中不易被氧化,Na2SO3·7H2O在空气中易被氧化。 |
(4)为了降低由中和器所得溶液中Na2SO3的溶解度,从而提高结晶产率,中和器中加入的NaOH是过量的。
①请结合Na2SO3的溶解平衡解释NaOH过量的原因_________。
②结晶时应选择的最佳操作是_________(选填字母)。
a.95~100℃加热蒸发,直至蒸干
B.维持95~100℃蒸发浓缩至有大量晶体析出
C.95~100℃加热浓缩,冷却至室温结晶
(5)为检验Na2SO3成品中是否含少量Na2SO4,需选用的试剂是_________、_________。
(6)KIO3滴定法可测定成品中Na2SO3的含量:室温下将0.1260g 成品溶于水并加入淀粉做指示剂,再用酸性KIO3标准溶液(x mol/L)进行滴定至溶液恰好由无色变为蓝色,消耗KIO3标准溶液体积为y mL。
①滴定终点前反应的离子方程式是: IO3-+
IO3-+ SO32- =
SO32- = _______ +
_______ + _______(将方程式补充完整)
_______(将方程式补充完整)
②成品中Na2SO3(M = 126 g/mol)的质量分数是_________。
-
Na2SO3应用广泛.利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的成本低,优势明显,其流程如下.
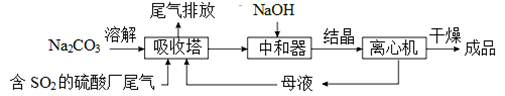
(1)举例说明向大气中排放SO2导致的环境问题:__________________。
(2)图为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化.则初期反应(图中A点以
前)的离子方程式是______________________。
(3)中和器中发生的主要反应的化学方程式是_______________________。
资料显示:
Ⅰ.Na2SO3在33℃时溶解度最大,将其饱和溶液加热至33℃以上时,由于溶解度低会析出无水Na2SO3,冷却至33℃以下时析出Na2SO3•7H2O;
Ⅱ.无水Na2SO3在空气中不易被氧化,Na2SO3•7H2O在空气中易被氧化.
(4)为了降低由中和器所得溶液中Na2SO3的溶解度,从而提高结晶产率,中和器中加入的NaOH是过量的。
①请结合Na2SO3的溶解平衡解释NaOH过量的原因_____________________。
②结晶时应选择的最佳操作是__(选填字母)。
a.维持33℃蒸发浓缩至有大量晶体析出
b.维持95~100℃蒸发浓缩至有大量晶体析出
c.95~100℃加热浓缩,冷却至室温结晶
(5)为检验Na2SO3成品中是否含少量Na2SO4,需选用的试剂是_________、________。
(6)0.1 mol•L﹣1 NaHSO3溶液中离子浓度由大到小的顺序是______________。
-
Na2SO3应用广泛。利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的成本低,优势明显,其流程如下。
(1)举例说明向大气中排放SO2导致的环境问题:_________。
(2)下图为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化。则初期反应(图中A点以前)的离子方程式是_________。

(3)中和器中发生的主要反应的化学方程式是_________。
| 资料显示: Ⅰ.Na2SO3在33℃时溶解度最大,将其饱和溶液加热至33℃以上时,由于溶解度降低会析出无水Na2SO3,冷却至33℃以下时析出Na2SO3·7H2O; Ⅱ.无水Na2SO3在空气中不易被氧化,Na2SO3·7H2O在空气中易被氧化。 |
(4)为了降低由中和器所得溶液中Na2SO3的溶解度,从而提高结晶产率,中和器中加入的NaOH是过量的。
①请结合Na2SO3的溶解平衡解释NaOH过量的原因_________。
②结晶时应选择的最佳操作是_________(选填字母)。
a.95~100℃加热蒸发,直至蒸干
B.维持95~100℃蒸发浓缩至有大量晶体析出
C.95~100℃加热浓缩,冷却至室温结晶
(5)为检验Na2SO3成品中是否含少量Na2SO4,需选用的试剂是_________、_________。
(6)KIO3滴定法可测定成品中Na2SO3的含量:室温下将0.1260g 成品溶于水并加入淀粉做指示剂,再用酸性KIO3标准溶液(x mol/L)进行滴定至溶液恰好由无色变为蓝色,消耗KIO3标准溶液体积为y mL。
①滴定终点前反应的离子方程式是: IO3-+
IO3-+ SO32- =
SO32- = _______ +
_______ + _______(将方程式补充完整)
_______(将方程式补充完整)
②成品中Na2SO3(M = 126 g/mol)的质量分数是_________。
-
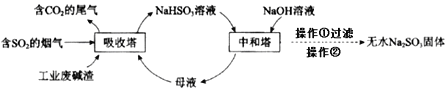
利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的流程如下:
下列说法错误的是
A. 向大气中排放SO2可能导致酸雨发生
B. 中和器中发生反应的离子方程式为HSO3-+OH-=SO32-+H2O
C. 进入离心机的分散系是悬浊液
D. 检验Na2SO3成品中是否含Na2SO4,可选用稀盐酸和Ba(NO3)2溶液
-
直接排放含SO2的烟气会危害环境。利用工业废碱渣(主要成分Na2CO3)可吸收烟气中的SO2并制备无水Na2SO3,其流程如图。
下列说法中不正确的是
A.吸收塔中的温度不宜过高,原因可能是防止SO2的溶解度下降
B.为提高NaHSO3的产率,应控制吸收塔中溶液为弱碱性
C.吸收塔中生成HSO3-的离子方程式是2SO2+CO32-+H2O=2HSO3-+CO2↑
D.操作②为蒸馏水洗涤、干燥,得无水Na2SO3固体
-
直接排放含SO2的烟气会危害环境。利用工业废碱渣(主要成分Na2CO3)可吸收烟气中的SO2并制备无水Na2SO3,其流程如图1。
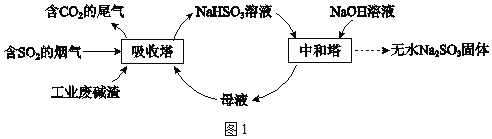
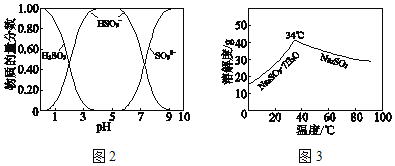
已知:H2SO3、HSO3﹣、SO32﹣在水溶液中的物质的量分数随pH的分布如图2,Na2SO3•7H2O 和Na2SO3的溶解度曲线如图3。
(1)Na2CO3溶液显碱性,用离子方程式解释其原因:_____。
(2)吸收烟气
①为提高NaHSO3的产率,应控制吸收塔中的pH为_____。
②NaHSO3溶液中c(SO32﹣)>c(H2SO3),结合方程式解释其原因:_____。
③已知下列反应:
SO2(g)+2OH﹣(aq)=SO32﹣(aq)+H2O(l) △H1=﹣164.3 kJ/mol
CO2(g)+2OH﹣(aq)=CO32﹣(aq)+H2O(l) △H2=﹣109.4 kJ/mol
2HSO3﹣(aq)=SO32﹣(aq)+SO2(g)+H2O(l) △H3=+34.0kJ/mol
吸收塔中Na2CO3溶液吸收SO2生成HSO3﹣的热化学方程式是__________。
④吸收塔中的温度不宜过高,可能的原因是_____(写出1种即可)。
(3)制备无水Na2SO3
将中和塔中得到的Na2SO3溶液_________(填操作),过滤出的固体用无水乙醇洗涤、干燥,得无水Na2SO3固体。
-
直接排放含SO2的烟气会危害环境。利用工业废碱渣(主要成分Na2CO3)可吸收烟气中的SO2并制备无水Na2SO3,其流程如图1。
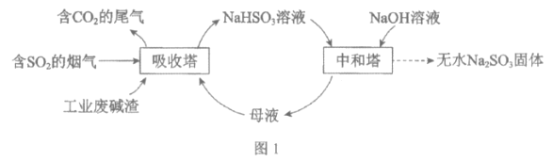
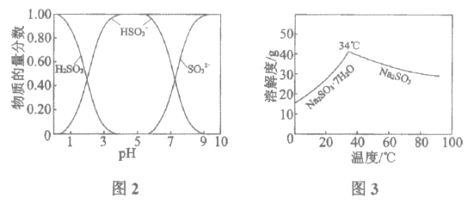
已知:H2SO3、HSO3-、SO32-在水溶液中的物质的量分数随pH的分布如图2, Na2SO3·7H2O和Na2SO3的溶解度曲线如图3。
(1)Na2CO3溶液显碱性,用离子方程式解释其原因:______________。
(2)吸收烟气
①为提高NaHSO3的产率,应控制吸收塔中的pH为______________。
②NaHSO3溶液中c(SO32-)>c(H2SO3),结合方程式解释其原因:____________。
③已知下列反应:
SO2(g)+2OH-(aq)=SO32-(aq)+H2O(l) 
CO2(g)+2OH-(aq)=CO32-(aq)+H2O(l) 
2HSO3-(aq)=SO32-(aq)+SO2(g)+H2O(l) 
吸收塔中Na2CO3溶液吸收SO2生成HSO3-的热化学方程式是______________。
④吸收塔中的温度不宣过高,可能的原因是______________(写出1种即可)。
(3)制备无水Na2SO3:将中和塔中得到的Na2SO3溶液______________(填操作),过滤出的固体用无水乙醇洗涤、干燥,得无水Na2SO3固体。