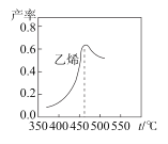
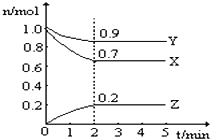
-
下列说法中正确的是( )
A.化学反应速率既有正值,又有负值。
B.测定某化学反应从开始到2秒末的反应速率,指的是2秒末的瞬时速率
C.对于同一化学反应,选用不同的物质表示化学反应速率时,其数值一定不同。
D.不能用固体和纯液体表示化学反应速率
难度: 简单查看答案及解析
-
在一支25mL的滴定管中盛入0.1mol/L HCl溶液,其液面恰好在5mL刻度处。若把滴定管内溶液全部放入烧杯中,再用0.1mol/L NaOH溶液进行中和,所需NaOH溶液的体积为( )
A.大于20mL B.小于20mL C.等于20mL D.等于5mL
难度: 简单查看答案及解析
-
下列有关电池的说法不正确的是
A.手机上用的锂离子电池属于二次电池
B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
C.甲醇燃料电池可把化学能转化为电能
D.锌锰干电池中,锌电极是负极
难度: 中等查看答案及解析
-
下列能量的转化过程中,由化学能转化为电能的是
A
B
C
D




水力发电
风力发电
铅蓄电池放电
太阳能发电
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列变化一定不可逆的是( )
A.溶解 B.电离 C.电解 D.水解
难度: 简单查看答案及解析
-
下列各项中电解质的电离方程式中正确的是( )
A.NaHCO3的水溶液:NaHCO3 = Na++H++
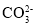
B.熔融状态的NaHSO4:NaHSO4 = Na++
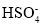
C.HF的水溶液:HF=H++F-
D.H2S 的水溶液:H2S
 2H++S2-
2H++S2-难度: 简单查看答案及解析
-
下列说法正确的是( )
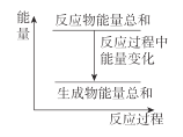
A.该过程是一个吸热过程
B.该图像可表示Ba(OH)2•8H2O与NH4Cl的反应
C.该过程的发生一定不需要外界的能量补充
D.该图像可以表示任意的燃烧反应
难度: 简单查看答案及解析
-
能表示人大量喝水时,胃液的pH变化的图像是( )
A.
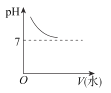 B.
B.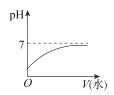
C.
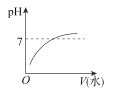 D.
D.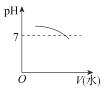
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.干冰汽化需要吸收大量的热,这个变化是吸收能量的化学反应
B.酒精可用作燃料,酒精燃烧是释放能量的反应
C.木炭需要加热到一定温度才能燃烧,所以木炭燃烧是吸收能量的反应
D.铝热反应放出大量的热(金属熔化),说明该反应常温下即可发生
难度: 简单查看答案及解析
-
下列应用与反应原理设计不一致的是( )
A.热的纯碱溶液清洗油污:CO
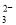 +H2O
+H2O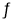 HCO
HCO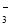 +OH-
+OH-B.明矾净水:Al3++3H2O
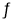 Al(OH)3+3H+
Al(OH)3+3H+C.用TiCl4制备TiO2:TiCl4+(x+2)H2O(过量)
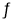 TiO2•xH2O↓+4HCl
TiO2•xH2O↓+4HClD.配制氯化亚锡溶液时加入氢氧化钠:SnCl2+H2O
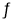 Sn(OH)Cl+HCl
Sn(OH)Cl+HCl难度: 中等查看答案及解析
-
反应C(s)+H2O(g)
 CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )A.增加C的量
B.将容器的体积缩小一半
C.保持体积不变,通入H2O(g)
D.保持压强不变,充入N2使容器体积增大
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.含有OH-的溶液一定呈碱性
B.pH为3的盐酸的c(H+)是pH为1的盐酸的100倍
C.Na2SO3溶液与NaHSO3溶液中所含微粒的种类一定相同
D.pH相同的氨水与氢氧化钠溶液,分别与同浓度同体积的盐酸完全中和时,消耗氨水与氢氧化钠溶液的体积一定相同
难度: 中等查看答案及解析
-
下列操作中,能使电离平衡H2O
 H+ + OH-正向移动且溶液呈酸性的是( )
H+ + OH-正向移动且溶液呈酸性的是( )A.向水中加入NaHSO4溶液 B.向水中加入Al2(SO4)3溶液
C.向水中加入Na2CO3溶液 D.将水加热到100℃,使水的pH=6
难度: 简单查看答案及解析
-
下列说法中正确的是
A.将纯水加热的过程中,Kw变大、pH变小
B.配制FeSO4溶液时,加入稀HNO3抑制Fe2+水解
C.FeCl3溶液蒸干、灼烧至恒重,最终得到FeCl3固体
D.向0.1mol/L氨水中加入少量水,溶液中
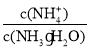 减小
减小难度: 简单查看答案及解析
-
强酸与强碱的稀溶液发生中和反应:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol。向1L0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸,②稀盐酸,③浓硫酸,恰好完全反应时对应的热效应ΔH1、ΔH2、ΔH3的关系正确的是( )
A.ΔH1<ΔH3<ΔH2 B.ΔH1>ΔH2>ΔH3
C.ΔH1<ΔH2<ΔH3 D.ΔH1>ΔH3>ΔH2
难度: 中等查看答案及解析
-
关于下列两个实验的说法正确的是( )
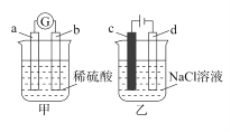
A.若甲中b电极的表面有气泡产生,则b为阳极
B.若甲中a为Zn,b为Cu,则正极附近的SO
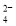 离子浓度逐渐增大
离子浓度逐渐增大C.若乙中c电极为Fe,则电解一段时间后,溶液变浑浊
D.若乙中c、d均为惰性电极,产生22.4LCl2时,则转移电子2mol
难度: 中等查看答案及解析
-
在密闭容器中,对于可逆反应:A(?)+3B(?)
 2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是
2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是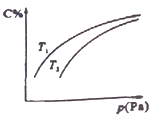
A.若正反应方向△H<0,则T1>T2 B.压强增大时,混合气体的平均相对分子质量减小
C.A一定为气体 D.B一定为气体
难度: 困难查看答案及解析
-
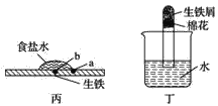
相同材质的铁在下列情形下最不易被腐蚀的是
A.
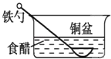 B.
B. 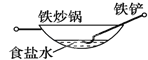
C.
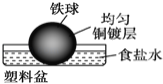 D.
D. 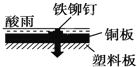
难度: 中等查看答案及解析
-
Cu2O是一种半导体材料,基于绿色化学理念设计的一种制取Cu2O的电解池示意图如下,电池总反应为2Cu+H2O
 Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是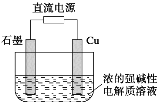
A.石墨电极上产生氢气
B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.当有0.1mol电子转移时,有0.1mol Cu2O生成
难度: 简单查看答案及解析
-
对于可逆反应A(g)+3B(s)
 2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是A.υ(A)=0.5mol/(L·min) B.υ(B)=1.2mol/(L·s)
C.υ(C)=0.1mol/(L·s) D.υ(D)=0.4mol/(L·min)
难度: 中等查看答案及解析
-
验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
①
②
③
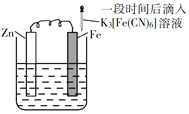
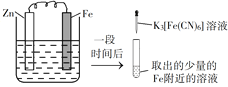
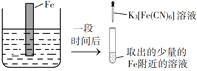
在Fe表面生成蓝色沉淀
试管内无明显变化
试管内生成蓝色沉淀
下列说法不正确的是
A.对比②③,可以判定Zn保护了Fe
B.对比①②,K3[Fe(CN)6]可能将Fe氧化
C.验证Zn保护Fe时不能用①的方法
D.将Zn换成Cu,用①的方法可判断Fe比Cu活泼
难度: 困难查看答案及解析
-
实验:①0.1mol·L-1AgNO3溶液和0.1mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;② 向滤液b中滴加0.1mol·L-1KI溶液,出现浑浊;③ 向沉淀c中滴加0.1mol·L-1KI溶液,沉淀变为黄色。下列分析不正确的是
A.浊液a中存在沉淀溶解平衡:AgCl(s)
 Ag+(aq)+ Cl-(aq)
Ag+(aq)+ Cl-(aq)B.滤液b中不含有Ag+
C.③中颜色变化说明AgCl 转化为AgI
D.实验可以证明AgI比AgCI更难溶
难度: 中等查看答案及解析
-
用电解法可提纯含有某些含氧酸根杂质的粗KOH溶液,其工作原理如图所示。下列有关说法错误的是
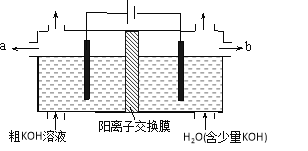
A.通电后阴极区附近溶液pH会增大
B.阳极反应式为4OH--4e-=2H2O+O2↑
C.纯净的KOH溶液从b出口导出
D.K+通过交换膜从阴极区移向阳极区
难度: 中等查看答案及解析
-
常温下,已知:1molCH4完全燃烧时放出890kJ的热量,1molH2完全燃烧时放出280kJ的热量。现有CH4和H2组成的混合气体共0.4mol,使其在O2中完全燃烧,恢复至常温共放出234kJ的热量,则CH4与H2的物质的量之比是( )
A.1:2 B.1:1 C.3:2 D.2:3
难度: 中等查看答案及解析
-
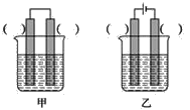
关于如图所示装置的判断,叙述正确的是( )
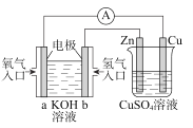
A.左边的装置是电解池,右边的装置是原电池
B.该装置中铜为正极,锌为负极
C.电子流向:Cu→经过CuSO4溶液→Zn→b
D.当铜片的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为2.24L
难度: 中等查看答案及解析
 NH3•H2O
NH3•H2O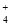 +OH-。
+OH-。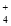 )=c(Cl-),则溶液显__(填“酸”“碱”或“中”)性。
)=c(Cl-),则溶液显__(填“酸”“碱”或“中”)性。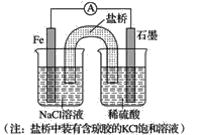
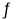 CH3OH+H2O。
CH3OH+H2O。