-
下列有关离子方程式一定不正确的是
A.氯气被足量的纯碱溶液完全吸收:2CO32- + Cl2 + H2O = 2HCO3-+ Cl- + ClO-
B.向一定量的NaOH溶液中通入一定量的CO2:OH- + CO2 = HCO3-
C.向FeCl3溶液中加入过量的Na2S溶液:2Fe3+ + S2- = 2Fe2+ + S↓
D.向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液至SO42−恰好完全沉淀NH4+ + Al3+ + 2SO42−+ 2Ba2+ + 4OH− = 2BaSO4↓+ Al(OH)3↓+ NH3·H2O
难度: 中等查看答案及解析
-
短周期主族元素m、n、p、q的原子序数依次增大,它们的最外层电子数之和为18,n3-与p2+具有相同的电子层结构。下列叙述错误的是 ( )
A.m、n、q一定均是非金属元素
B.离子半径的大小:q>n>p
C.最高价氧化物对应水化物的酸性:q>n>m
D.m、n、p分别与q形成的二元化合物均含有共价键
难度: 中等查看答案及解析
-
反应
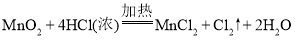 中,氧化产物与还原产物的物质的量之比是( )
中,氧化产物与还原产物的物质的量之比是( )A.1:2 B.1:1 C.2:1 D.4:1
难度: 中等查看答案及解析
-
下列说法正确的是
A.用氨水可以鉴别MgCl2溶液和AlCl3溶液
B.可以用澄清的石灰水鉴别SO2和CO2
C.SO2能使FeCl3、KMnO4水溶液褪色
D.金属钠与CuSO4溶液反应能析出单质Cu
难度: 简单查看答案及解析
-
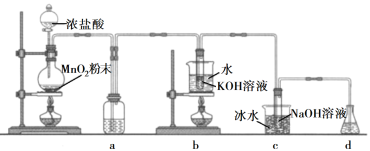
向足量的浓盐酸中加入8.7g二氧化锰并加热,充分反应后,被氧化的HCl的物质的量为
A.小于0.2mol B.等于0.2mol
C.在0.2mol和0.4mol之间 D.等于0.4mol
难度: 中等查看答案及解析
-
将一定质量的镁、铜合金加入稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol·L-1NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是
A.加入合金的质量可能为9.6g
B.沉淀完全时消耗NaOH溶液体积为150mL
C.参加反应的硝酸的物质的量为0.4mol
D.溶解合金时产生NO气体体积2.24L
难度: 困难查看答案及解析
-
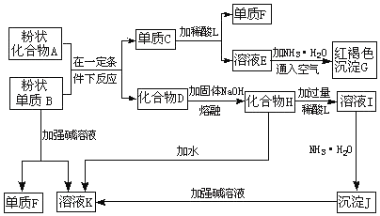
白色固体混合物A,含有KCl、CaCO3、Na2CO3、Na2SiO3、CuSO4中的几种,常温常压下进行如下实验(已知Ag2SO4可溶于硝酸)。
①A溶于足量水,最终得到无色溶液B和固体C
②固体C与过量稀硝酸作用得到无色气体D,蓝色溶液E和固体F
下列推断不正确的是
A.无色溶液B的pH≥7
B.固体F中有H2SiO3
C.混合物A中一定含有Na2SiO3、CuSO4和CaCO3
D.溶液B加HNO3酸化,无沉淀;再加AgNO3,若有白色沉淀生成,则A中有KCl
难度: 困难查看答案及解析
-
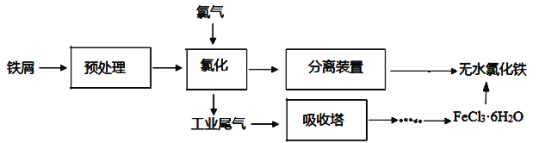
以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下,下列说法不正确的是( )
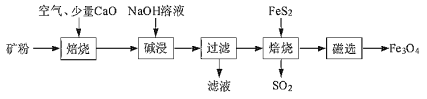
A.焙烧时产生的SO2气体可以用NaOH溶液吸收
B.滤液中的铝元素主要以AlO2-存在,可以往滤液中通入过量二氧化碳,经过滤、灼烧生产氧化铝
C.可以将少量Fe3O4产品溶于稀硫酸中,再滴入酸性高锰酸钾溶液,若溶液褪色则证明产品中含有FeO
D. Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2):n(Fe2O3)=1:16
难度: 中等查看答案及解析
 2NH3 (g)的ΔH < 0,ΔS >0
2NH3 (g)的ΔH < 0,ΔS >0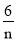 molKClO3
molKClO3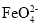 )具有优异的氧化漂白、优良的杀菌消毒作用。
)具有优异的氧化漂白、优良的杀菌消毒作用。