-
化学是一门中心学科,是人类进步的关键。下列说法正确的是
A.我国古代四大发明中有三项与化学反应密切相关
B.为防止蛋白质变性,疫苗应在冷冻条件下贮存
C.侯德榜制碱法的工艺包括制碱和制氯化铵两个过程
D.生产口罩所用的无纺熔喷布的主要材料为聚丙烯,其结构简式为
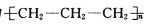
难度: 中等查看答案及解析
-
阿司匹林(Aspirin,乙酰水杨酸)具有解热止痛,抑制血小板凝聚,防止血栓形成的功效,是家庭中常备药品。水杨酸与乙酸酐反应制取阿司匹林的原理如图:
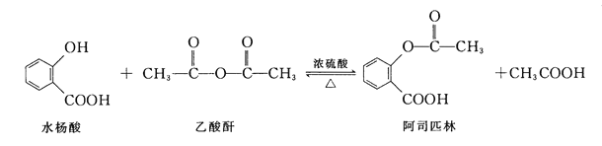
下列有关说法错误的是
A.水杨酸分子中所有原子可能共面
B.水杨酸的同分异构体中,属于苯环上二元取代物的还有5种(不考虑过氧键)
C.乙酰水杨酸在一定条件下能发生加成、水解、酯化等反应
D.分离乙酰水杨酸和乙酸可以加入饱和Na2CO3溶液后分液
难度: 中等查看答案及解析
-
已知某二元酸H2A在溶液中存在如下电离:H2A=H++HAˉ,HAˉ
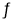 H++A2ˉ,K=1.2×10-2。设NA为阿伏加德罗常数值。关于常温下0.01mol·L-1的H2A溶液,下列说法正确的是
H++A2ˉ,K=1.2×10-2。设NA为阿伏加德罗常数值。关于常温下0.01mol·L-1的H2A溶液,下列说法正确的是A.
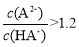
B.pH<2
C.c(H+)=2c(H2A)+c(HAˉ)+c(OHˉ)
D.1L溶液中的H+数目为0.02NA
难度: 中等查看答案及解析
-
M、X、Y、Z为4种原子序数依次增大的短周期主族元素,其原子序数之和为22。已知M、Y形成的化合物使湿润的红色石蕊试纸变蓝色,M、Z形成化合物的水溶液可以蚀刻玻璃,4种元素形成某种化合物的结构式为
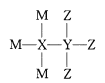 。下列说法正确的是
。下列说法正确的是A.X、Y均不属于第ⅣA族元素
B.原子半径:Y>X>Z>M
C.M与Y、Z三种元素只能形成共价化合物
D.该化合物中每种原子的最外层都达到了8电子稳定结构
难度: 简单查看答案及解析
-
某兴趣小组利用索氏提取器,用石油醚做溶剂从花生仁中提取油脂,装置如图。石油醚的主要成分为戊烷和已烷的混合物,沸程为:30℃~60℃。下列说法错误的是

A.石油醚易挥发易燃烧,提取过程不可选用明火直接加热
B.石油醚的沸程较大,加热前不必加入沸石
C.烧瓶中的石油醚受热经侧管进入冷凝管,冷却后进入滤纸套筒与碎花生接触进行萃取
D.索氏提取器使用溶剂少,可循环连续萃取,萃取效率高
难度: 中等查看答案及解析
-
我国学者最近研发一种新型铝—石墨烯电池,其负极是金属铝,正极是石墨烯(Cn)薄膜,电解质为阳离子(EMI+)与阴离子(
 )组成的离子液体,该电池的工作原理如图。已知能量密度是指一定质量物质中储存能量的大小。下列说法错误的是
)组成的离子液体,该电池的工作原理如图。已知能量密度是指一定质量物质中储存能量的大小。下列说法错误的是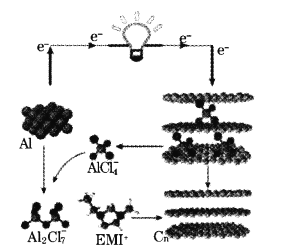
A.该铝电极电池比锂电极电池的能量密度低
B.石墨烯电极的比表面积大,充放电性能优于石墨电极
C.充电时,有机阳离子(EMI+)向铝电极移动
D.放电时,负极的电极反应式为2Al+7Clˉ-6eˉ=Al2Cl
难度: 中等查看答案及解析
-
室温下,用0.10 mol·L-1NaOH溶液滴定20 mL 0.10 mol·L-1HA溶液,测得混合溶液的pH与lg
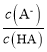 的关系如图所示。下列叙述正确的是
的关系如图所示。下列叙述正确的是
A.HA为弱酸,Ka的数量级为10-3
B.b点时消耗NaOH溶液的体积大于20 mL
C.溶液的导电能力:b>a
D.b点溶液中:c(Na+)=c(Aˉ)=(H+)=c(OHˉ)=10-7mol/L
难度: 中等查看答案及解析
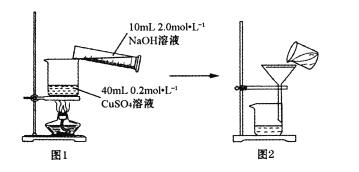
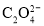 、用标准EDTA溶液(PAR为指示剂)滴定Cu2+,经计算样品中n(Cu):n(
、用标准EDTA溶液(PAR为指示剂)滴定Cu2+,经计算样品中n(Cu):n(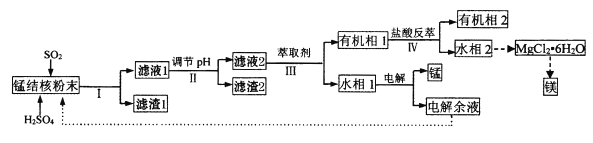
 ),过二硫酸盐水解生成H2O2溶液和硫酸氢盐,生成的硫酸氢盐可以循环使用。电解硫酸氢盐溶液时阳极的电极反应式为_______。写出过二硫酸盐水解的离子方程式________。
),过二硫酸盐水解生成H2O2溶液和硫酸氢盐,生成的硫酸氢盐可以循环使用。电解硫酸氢盐溶液时阳极的电极反应式为_______。写出过二硫酸盐水解的离子方程式________。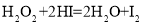 在不同浓度时的化学反应速率如表:
在不同浓度时的化学反应速率如表: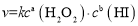 ,其中k为速率常数。
,其中k为速率常数。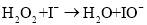 慢
慢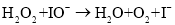 快
快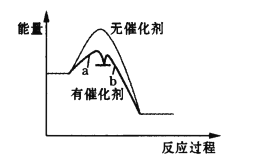
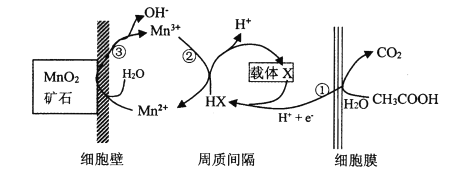
 体系(其中
体系(其中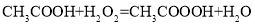 )氧化苯乙烯制取苯甲醛,反应的副产物主要为苯甲酸和环氧苯乙烷。一定条件下,测得一定时间内温度对氧化反应的影响如图:
)氧化苯乙烯制取苯甲醛,反应的副产物主要为苯甲酸和环氧苯乙烷。一定条件下,测得一定时间内温度对氧化反应的影响如图: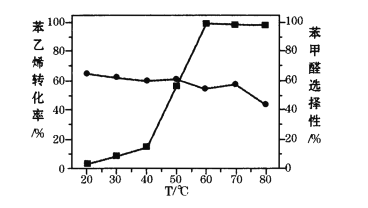
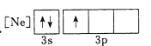 B.
B. 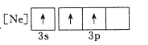
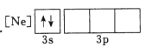 D.
D. 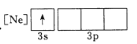
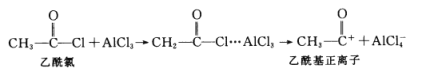
 的空间构型为________。
的空间构型为________。

 (2)
(2)
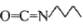 为原料,其他无机试剂自选,参照上述格列本脲的合成路线,设计一条制备甲磺丁脲(
为原料,其他无机试剂自选,参照上述格列本脲的合成路线,设计一条制备甲磺丁脲(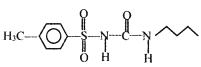 )的合成路线_____________.
)的合成路线_____________.