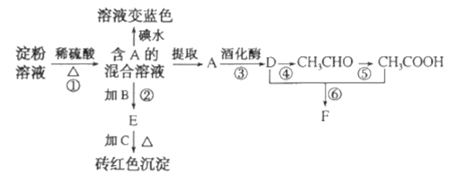
-
化学与生活、社会发展息息相关。下列说法正确的是
A.燃料电池的能转量化率可达100%
B.“熔喷布”可制作N95型等口罩,生产“熔喷布”的主要原料是聚丙烯,它属于纯净物
C.体积分数75%的乙醇溶液可用于医疗消毒
D.84消毒液与酒精混用杀菌消毒效果更好
难度: 简单查看答案及解析
-
下列事实对应的化学用语表达错误的是
A.自然界中正常的雨水呈酸性:H2O+CO2
 H2CO3 ,H2CO3
H2CO3 ,H2CO3 H++HCO3-
H++HCO3-B.“NO2球”浸入冷水中颜色变浅:2NO2(g)(红棕色)
 N2O4(g)(无色) ΔH<0
N2O4(g)(无色) ΔH<0C.硫代硫酸钠溶液与稀硫酸混合出现浑浊:S2O32-+2H+==S↓+SO2↑+H2O
D.甲烷的燃烧热为ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)==CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
难度: 简单查看答案及解析
-
1909年,丹麦生理学家索仑生提出用pH表示水溶液的酸度:pH=-lg[H+],后来又定义pOH=-lg[OH-],pKW=-lgKW。对某水溶液的下列说法中错误的是
A.pH+pOH=pKW B.若为酸性溶液则pH>pOH
C.常温下pH+pOH=14 D.溶液pH=7时未必呈中性
难度: 简单查看答案及解析
-
下列事实不能用勒夏特列原理解释的是( )
A.FeCl3+3KSCN
 Fe(SCN)3+3KCl平衡体系中加入少量KSCN固体,溶液颜色加深
Fe(SCN)3+3KCl平衡体系中加入少量KSCN固体,溶液颜色加深B.工业合成氨中,将氨气液化分离
C.A、B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B中试管中产生气泡快
D.对于反应2NO2(g)
 N2O4(g) △H<0,升高温度可使体系颜色变深
N2O4(g) △H<0,升高温度可使体系颜色变深难度: 中等查看答案及解析
-
化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ/mol) P—P:198,P—O:360,O=O:498,则反应P4(白磷)+3O2
 P4O6
P4O6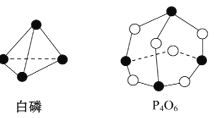
A. 放出1 638 kJ热量
B. 吸收1 638 kJ热量
C. 放出126 kJ热量
D. 吸收126 kJ热量
难度: 简单查看答案及解析
-
2molA与2molB混合于2L的密闭容器中,发生如下反应:2A(g)+3B(g)
 2C(g)+zD(g),2s末A的转化率为50%,测得v(D)=0.25mol•L﹣1•s﹣1,下列推断不正确的是
2C(g)+zD(g),2s末A的转化率为50%,测得v(D)=0.25mol•L﹣1•s﹣1,下列推断不正确的是A.2s末,B的浓度为0.5mol/L B.2s末,容器内的压强是初始的7/8倍
C.2s时C的体积分数为2/7 D.z=2
难度: 中等查看答案及解析
-
NOx含量的测定,是将气体样品通入适量酸化的H2O2溶液中,使NOx完全被氧化成NO3-,加水稀释,量取该溶液,加入FeSO4标准溶液(过量),充分反应后,用K2Cr2O7标准溶液滴定剩余的Fe2+下列说法不正确的是
A.NO被H2O2氧化为
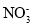 的离子方程式为2NO+3H2O2=2H++2
的离子方程式为2NO+3H2O2=2H++2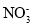 +2H2O
+2H2OB.滴定操作使用的玻璃仪器有酸式滴定管
C.若FeSO4标准溶液部分变质,会使测定结果偏高
D.气体样品中混有空气,测定结果会偏高
难度: 困难查看答案及解析
-
25℃时,水的电离达到平衡:H2O
 H++OH- △H>0,下列叙述正确的是( )
H++OH- △H>0,下列叙述正确的是( )A.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
B.向水中加入氨水,平衡逆向移动,c(OH-)降低
C.向水中加入固体硫酸铜,平衡逆向移动,c(OH-)减小
D.将水加热,Kw增大,pH不变
难度: 中等查看答案及解析
-
室温下,将0.05 mol Na2CO3固体溶于水配成100 mL溶液,向溶液中加入下列物质,有关结论正确的是( )
加入物质
结论
A
50 mL 1 mol·L-1H2SO4
反应结束后,c(Na+)=c(SO
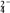 )
)B
0.05 mol CaO
溶液中
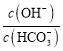 增大
增大C
50 mL H2O
由水电离出的c(H+)·c(OH-)不变
D
0.1 mol NaHSO4固体
反应完全后,溶液pH减小,c(Na+)不变
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
国际计量大会第26届会议修订了阿伏加德罗常数(NA=6.02214076×1023mol-1),于2019年5月20日正式生效。设NA是阿伏加德罗常数的值,下列说法正确的是
A.lmolOD-中含有的质子数和中子数均为9NA
B.常温下,pH=l2的Ba(OH)2溶液中的OH-数目为0.01NA
C.100mL0.1mol·L-1的氨水溶液中含有0.0lNA个NH4+
D.25°C时,1LpH=2的H2C2O4溶液中含H+的数目小于0.01NA
难度: 中等查看答案及解析
-
G—TEC燃料电池以利用民用燃气为原料气,其结构如图,有关该电池的说法不正确的是
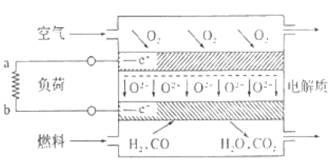
A.电池工作时,电流由负荷的a流向b
B.电池工作一段时间后,电解质物质的量理论上保持不变
C.通入空气的一极的电极反应式是:O2+2H2O+4e-=4OH-
D.外电路中每通过0.2mol电子,所消耗的燃料体积不小于2.24L(标况下)
难度: 中等查看答案及解析
-
下列有关说法中正确的是( )
A.2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+ 2CO2(g)在低温下能自发进行,则该反应的△H<0
B.NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,说明该反应的△H <0
C.若△H>0,△S<0,化学反应在任何温度下都能自发进行
D.加入合适的催化剂能降低反应活化能,从而改变反应的焓变
难度: 简单查看答案及解析
-
下列说法不正确的是
A.Na与H2O的反应是熵增的放热反应,该反应能自发进行
B.饱和Na2SO4溶液或浓硝酸均可使蛋白质溶液产生沉淀,但原理不同
C.FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
D.Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)
 Mg2+(aq)+2OH—(aq),该固体可溶于NH4Cl溶液
Mg2+(aq)+2OH—(aq),该固体可溶于NH4Cl溶液难度: 简单查看答案及解析
-
一定温度下,反应N2O4(g)
 2NO2(g)的焓变为ΔH。现将1mol N2O4充入一恒压密闭容器中,下列示意图能说明反应达到平衡状态的是( )
2NO2(g)的焓变为ΔH。现将1mol N2O4充入一恒压密闭容器中,下列示意图能说明反应达到平衡状态的是( )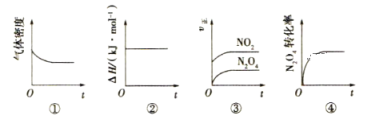
A.①② B.②④ C.③④ D.①④
难度: 中等查看答案及解析
-
电解法在金属精炼、保护环境、处理废水中起着十分重要的作用。电解法处理酸性含铬废水(主要含有
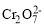 )时,以铁板作阴、阳极,处理过程中存在反应
)时,以铁板作阴、阳极,处理过程中存在反应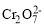 +6Fe2++14H+=2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去。下列说法不正确的是
+6Fe2++14H+=2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去。下列说法不正确的是A.阴极电极反应式:2H++2e-=H2↑
B.阳极电极反应式:Fe-2e-=Fe2+
C.当生成1molCr(OH)3时,电路中转移电子的物质的量至少为3mol
D.电解过程中水解平衡右移有Fe(OH)3沉淀生成
难度: 中等查看答案及解析
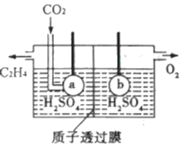
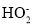 ,写出正极反应式__________。
,写出正极反应式__________。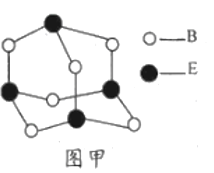
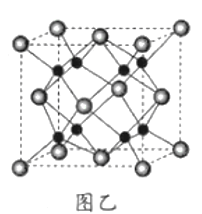
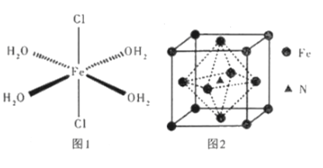
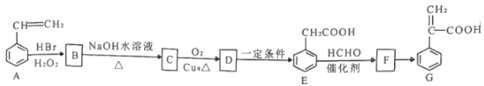
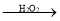 CH3CH2CH2Br
CH3CH2CH2Br HOCH2CH2COOH
HOCH2CH2COOH