-
A、B、C、D、E五种元素位于元素周期表中前四周期,原子序数依次增大。A元素的价电子排布为nsnnpn+1;B元素原子最外层电子数是次外层电子数的3倍;C位于B的下一周期,是本周期最活泼的金属元素;D基态原子的3d原子轨道上的电子数是4s原子轨道上的4倍;E元素原子的4p轨道上有3个未成对电子。回答下列问题(用元素符号表示或按要求作答)。
(1)A、B、C的第一电离能由小到大的顺序为____________,三者电负性由大到小的顺序为_________。
(2)A和E的简单气态氢化物沸点高的是______,其原因是_________。
(3)D3+基态核外电子排布式为_________________。
(4)E基态原子的价电子轨道表示式为___________。
(5)B和E形成分子的结构如图所示,该分子的化学式为_______,E原子的杂化类型为________。
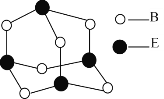
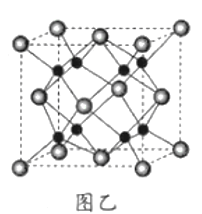
(6)B和C能形成离子化合物R,其晶胞结构如图所示:
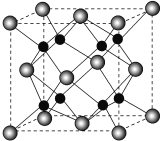
①一个晶胞中含______个B离子。R的化学式为__________。
②晶胞参数为a pm,则晶体R的密度为_____________g•cm-3(只列计算式)。
-
周期表中的五种元素A、B、D、E、F,原子序数依次增大,A的基态原子价层电子排布为nsnnpn;B的基态原子2p能级有3个单电子;D是一种富集在海水中的元素,含量位于海水中各元素的第三位;E2+的3d轨道中有10个电子;F位于第六周期,与Cu同族,其单质在金属活动性顺序表中排在末位。
(1)写出E的基态原子的价层电子排布式___________。
(2)A、B形成的AB﹣常作为配位化合物中的配体,其A原子的杂化方式为________,AB﹣中含有的σ键与π键的数目之比为________。
(3)FD3是一种褐红色晶体,吸湿性极强,易溶于水和乙醇,无论是固态、还是气态,它都是以二聚体F2D6的形式存在,依据以上信息判断FD3,晶体的结构属于____晶体,写出F2D6的结构式________。
(4)E、F均能与AB﹣形成配离子,已知E与AB﹣形成的配离子为正四面体形。F(+1价)与AB形成的配离子为直线形,工业上常用F和AB﹣形成的配离子与E反应来提取F单质,写出E置换F的离子方程式_________________。
(5)F单质的晶体为面心立方最密堆积,若F的原子半径为a nm,F单质的摩尔的的质量为Mg/mol,阿伏加德罗常数为NA,求F单质的密度为______g/cm3。(用a、NA、M的代数式表示)
-
(11分)A、 X、Y、Z、R、W均为周期表中前四周期的元素,其中原子序数依次增大;A原子价电子排布式nsnnpn+1, X2-和Y+有相同的核外电子排布;Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质。回答下列问题(相关回答均用元素符号表示):
(1)R基态原子的核外电子排布式是______________________。W在周期表中的位置是
(2)NH4Cl晶体中含有多种化学键,其中一定不含有的化学键是 (填字母)。
A.离子键 B.极性键 C.配位键 D.金属键
(3)A原子的第一电离能 (填“大于”、“小于”或“等于”)X原子的第一电离能;A元素的氢化物是一种易液化的气体,该气体易液化的原因是 。
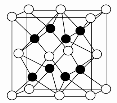
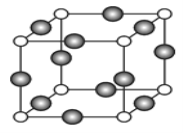
(4)X与Y形成的化合物Y2X2的电子式 ,其晶体类型 。X与Y形成的化合物的晶胞如图所示,则该化合物的化学式为________(请用推断出的元素符号表示)。
(5)Z的某种含氧酸盐常用于实验室制取X形成的单质,此酸根离子的空间构型为___________ 。
-
A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:
| 元素 | 相关信息 |
| A | 基态原子的价电子排布式为nSnnPn |
| B | 元素原子的核外p电子数比s电子数少1个 |
| C | 最外层电子数是电子层数的3倍 |
| D | 简单离子是第三周期元素中离子半径最小的 |
| E | 价电子层中的未成对电子数为4 |
请回答下列问题:
(1)写出下列元素的名称:A______, B_______, C________,D__________
(2)写出C元素在周期表的位置_________,E2+价电子的轨道表示式________________,B元素能量最高的电子为_____轨道上的电子,其轨道呈_______形.
(3)按原子轨道的重叠方式,1molA与C形成的最高价化合物中σ键有______个,π键有______个。
(4)B、C、D的简单离子的半径由大到小的顺序为_____________(用离子符号表示)。
(5)写出C的核外有18个电子的氢化物的电子式_____________。
-
A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:
| 元素 | 相关信息 |
| A | 基态原子的价电子排布式为nSnnPn |
| B | 元素原子的核外p电子数比s电子数少1个 |
| C | 最外层电子数是电子层数的3倍 |
| D | 简单离子是第三周期元素中离子半径最小的 |
| E | 价电子层中的未成对电子数为4 |
请回答下列问题:
(1)写出下列元素符号:A______, B_______,C________,D__________。
(2)写出C元素在周期表的位置_________,E2+价电子的轨道表示式______________,B元素能量最高的电子为____轨道上的电子,其轨道呈______形。
(3)按原子轨道的重叠方式,1molA与C形成的最高价化合物中σ键有______个,π键有______个。(阿伏加德罗常数的值用NA表示)
(4)B、C、D的简单离子的半径由大到小的顺序为________(用离子符号表示)。
(5)写出C的核外有18个电子的氢化物的电子式_____________。
-
A、B、C、D、E为原子序数依次增大的五种前四周期元素。A的核外电子总数与其 周期数相同;B的价电子排布式为nsnnpn+2;C、D为同周期元素,C是同周期元素中离子半径最小的元素,D元素最外层有一个未成对电子;E位于元素周期表的第四周期第IVB族,常用加热ED4溶液的方法制备纳米材料。
回答下列问题:
(1)D原子的价电子排布图为___________,E原子核外有_____个未成对电子,五种元素中电负性最大的是___________(填元素符号)。
(2)化合物D2B的中心原子的杂化方式为______________,它的VSEPR模型名称____________,分子的立体构型为_____________。
(3)与分子晶体D2B3互为等电子体的一种分子为____________(填化学式)。
(4)由A、B、D三种元素所形成的一系列化合物中氧化性最强的是_______(填化学式,下同),酸性最强的是_________________。
(5)单质B有两种同素异形体,其中沸点高的是______(填分子式),原因是__________。
(6)C与D能形成化合物Q。在1.01×105Pa、T1℃时,气体摩尔体积为53.4L/mol,实验测得Q的气态密度为5.00g/L,则此时Q的化学式为____________________。
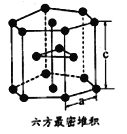
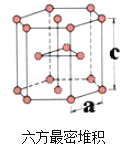
(7)E单质有两种同素异形体,高温下是体心立方堆积,但在常温下的晶体结构为如图所示的六方最密堆积。已知晶胞参数分别为acm和ccm,则该晶体的密度可表示为______g·cm-3。(用含a和c的式子表示,用NA表示阿伏伽德罗常数的值)。
 。
。
-
A、B、C、D、E为原子序数依次增大的五种前四周期元素。A的核外电子总数与其周期数相同;B的价电子排布式为nsnnpn+2;短周期元素C和D为同周期不相邻的元素,C是同周期元素中离子半径最小的元素,D元素最外层有两个未成对电子;E位于元素周期表的第四周期第IVB族,常用加热ECl4(氯化物)溶液的方法制备纳米材料。回答下列问题:
(1)D元素在周期表中的位置为______,E原子核外有_____个未成对电子,五种元素中电负性最大的是_____(填元素名称)。
(2)由A、B、D三种元素形成的常见三元化合物中具有强氧化性的是______(填化学式)。
(3)氯元素能与C(非碳元素符号)形成某化合物Q。在1.01×105Pa、T1℃时,气体摩尔体积为53.4L/mol,实验测得Q的气态密度为5.00g/L,则此时Q的结构式为___________。(如有配位键须用“→”标出)
(4)A、B、D元素形成的化合物有A2B、DB3,下列关于A2B和DB3的说法中,正确的是________(填标号)。
A.中心原子的价层电子对数目相等 B.都是非极性分子
C.中心原子的孤电子对数目相等 D.都含有极性键
E.都能与Na2O反应 F.固态时晶体类型不同
(5)D在空气中燃烧的产物分子构型为_________。固体DB3中存在如图所示的三聚分子,该分子中D原子的杂化轨道类型为________。

(6)E单质有两种同素异形体,高温下是体心立方堆积;但在常温下的晶体结构为如下图所示的六方最密堆积(底面是正六边形)。已知常温下晶体晶胞参数分别为a cm和c cm,则该晶体的密度可表示为________g·cm-3。(用含a和c的式子表示,用NA表示阿伏伽德罗常数的值)。
-
A、B、C、D、E为原子序数依次增大的五种前四周期元素。A的核外电子总数与其周期数相同;B的价电子排布式为nsnnpn+2;短周期元素C和D为同周期不相邻的元素,C是同周期元素中离子半径最小的元素,D元素最外层有两个未成对电子;E位于元素周期表的第四周期第IVB族,常用加热ECl4(氯化物)溶液的方法制备纳米材料。回答下列问题:
(1)D元素在周期表中的位置为__________________,E原子核外有_____个未成对电子,五种元素中电负性最大的是___________(填元素名称)。
(2)由A、B、D三种元素形成的常见三元化合物中具有强氧化性的是______(填化学式)。
(3)A、B、D元素形成的化合物有A2B、DB3,下列关于A2B和DB3的说法中,正确的是______(填标号)。
A.中心原子的价层电子对数目相等B.都是非极性分子C.中心原子的孤电子对数目相等D.都含有极性键E.都能与Na2O反应F.固态时晶体类型不同
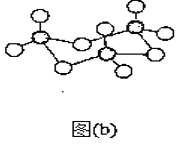
(4)D在空气中燃烧的产物分子构型为______。固体DB3中存在如图(b)所示的三聚分子,该分子中D原子的杂化轨道类型为________。
-
已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数, A的原子半径小于B,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素。E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子。
(1)基态E原子的价电子排布图_______________。
(2)B、C、D三元素第一电离能由大到小的顺序为(用元素符号表示)______________。
(3)BD 中心原子杂化轨道的类型为______杂化;CA
中心原子杂化轨道的类型为______杂化;CA 的空间构型为_______(用文字描述)。
的空间构型为_______(用文字描述)。
(4)1 mol BC-中含有π键的数目为______。
(5)比较D、E元素最简单氢化物的稳定性_______(填化学式,用“>”连接),理由是_______________。
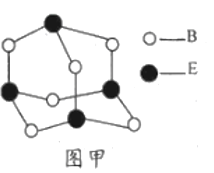
(6)C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是____,C原子的配位数是_____。若相邻C原子和F原子间的距离为anm,阿伏伽德罗常数为NA,则该晶体的密度为______g/cm3(用含a、NA的符号表示)。
-
A、B、C、D、E、F是元素周期表前四周期中原子序数依次增大的六种常见元素,其相关信息如下表:
| 元素 | 相 关 信 息 |
| A | 原子核外有7种运动状态不同的电子 |
| B | 外围电子排布式为nsnnpn+2 |
| C | 常见的金属,在周期表中周期序数与族序数相等 |
| D | 气态氢化物及最高价氧化物对应的水化物均为强酸 |
| E | 一种核素的质量数为56,中子数为30 |
| F | 单质紫红色,电缆材料,常见氧化物为黑色 |
回答下列问题:
(1)元素E在元素周期表中的位于第四周期第__族,其高价态离子核外有__个未成对电子
(2)B、C、D三种元素的离子半径由小到大的顺序是______(用离子符号表示).
(3)A、D两元素的简单氢化物发生反应生成的化合物的电子式为_______
(4)常温下AD3是一种淡黄色液体。以下关于AD3的说法中,正确的是__________
A.AD3分子中只有非极性键 B.AD3分子中各原子均达8e-稳定结构
C.AD3的晶体属于分子晶体 D.AD3液体气化时化学键被破坏
(5)金属C与E的黑色磁性晶体氧化物在高温下反应,该反应的化学方程式为___________________
(6)向F的硫酸盐溶液中通入AH3气体至过量,观察到的现象是__________;该过程总的离子反应式为________________向反应后的溶液中加入适量乙醇,析出深蓝色晶体,该晶体中不含有的化学键类型是________
A.配位键 B.极性共价键 C.非极性共价键 D.离子键



 。
。


