-
在下列溶液中,各组离子一定能够大量共存的是:( )
A.使酚酞试液变红的溶液: Na+、Cl-、SO42-、Fe3+
B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
C.c(H+)=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br-
D.碳酸氢钠溶液:K+、SO42-、Cl-、H+
难度: 简单查看答案及解析
-
将pH=3的盐酸溶液和pH=11的氨水等体积混合后,溶液中离子浓度关系正确的是
A. c(NH4+)>c(Cl–)>c(H+)>c(OH–) B. c(NH4+)>c(Cl–)>c(OH–)>c(H+)
C. c(Cl–)>c(NH4+)>c(H+)>c(OH–) D. c(Cl–)>c(NH4+)>c(OH–)>c(H+)
难度: 困难查看答案及解析
-
在墨西哥坎昆举行的世界气候大会于2010年12月10日闭幕,大会取得成功,《京都议定书》得到支持,“低碳生活”已成为新的时尚流行全球。“低碳生活”是指生活作息时所耗用能量要减少,从而降低碳特别是二氧化碳的排放。下列行为不利于“低碳生活”的是
A. 用大排量的轿车代替公交车出行
B. 将碳进行气化处理,提高煤的综合利用率
C. 开发太阳能、水能、风能等新能源,减少使用煤、石油等化石燃料
D. 实现资源的“3R”利用观,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、资源的重复再生(Recycle)
难度: 中等查看答案及解析
-
共价键、离子键、金属键、分子间作用力都是微粒间的作用力,下列物质只含有以上一种作用力的是
A. H2 B.
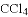 C.
C. 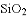 D.
D. 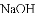
难度: 简单查看答案及解析
-
将SO2通入BaCl2溶液至饱和,未见有沉淀,继续通入另一种气体X仍无沉淀,则X可能是
A. CO2 B. NH3 C. NO2 D. H2S
难度: 简单查看答案及解析
-
下列说法中正确的是(NA为阿伏加德罗常数)
A. 78 gNa2O2晶体中所含阴阳离子个数均为2NA
B. 1.5 g CH3+中含有的电子数为NA
C. 3.4 g氨中含有0.6NA个N—H键
D. 常温下,100 mL1 mol·L-1AlCl3溶液中阳离子总数小于0.1NA
难度: 中等查看答案及解析
-
如下图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是
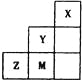
A. 非金属性:
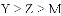
B. 离子半径:
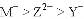
C. ZM2分子中各原子的最外层均满足8电子稳定结构
D. 三种元素中,Y的最高价氧化物对应的水化物酸性最强
难度: 中等查看答案及解析
-
有某可逆反应aA(g)+bB(g)
 cC(g);△H="Q" kJ/mol如图表示外界条件(温度、压强)的变化对上述反应的影响。下列判断正确的是
cC(g);△H="Q" kJ/mol如图表示外界条件(温度、压强)的变化对上述反应的影响。下列判断正确的是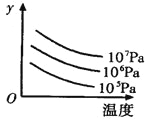
A. a+b<c时,y轴表示平衡混合气中C的质量分数
B. a+b>c时,y轴表示平衡混合气的平均摩尔质量
C. Q > 0时,y轴表示达到平衡时B的转化率
D. Q < 0时,y轴表示达到平衡时A的浓度
难度: 困难查看答案及解析
-
下列比值为2∶1的是
A. pH=2与pH=1的硝酸中c(H+)之比
B. Na2CO3溶液中c(Na+)与c(CO32ˉ )之比
C. 0.2mol/L与0.1mol/L醋酸中c(H+)之比
D. NO2溶于水时,被氧化的n(NO2)与被还原的n(NO2)之比为
难度: 简单查看答案及解析
-
在一定温度下的定容密闭容器中,当下列物理量不再改变时,表明反应:A(s)+2B(g)
 C(g)+D(g) 已达平衡的是
C(g)+D(g) 已达平衡的是A. 混合气体的压强 B. 混合气体的密度
C. B物质的相对分子质量 D. 气体的总物质的量
难度: 中等查看答案及解析
-
用含少量镁粉的铝粉制取纯净的氢氧化铝,下述操作步骤中最恰当的组合是①加盐酸溶解;②加烧碱溶液溶解;③过滤;④通入过量CO2生成Al(OH)3沉淀;⑤加入盐酸生成Al(OH)3沉淀;⑥加入过量烧碱溶液。
A. ①⑥⑤③ B. ②③⑤③ C. ②③④③ D. ①③⑤③
难度: 中等查看答案及解析
-
下列反应中,相关示意图像错误的是
A
B
C
D
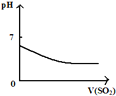
将二氧化硫通入到
一定量氯水中
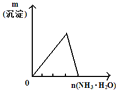
将氨水滴入到一定量氯化铝溶液中
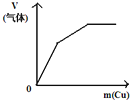
将铜粉加入到一定量
浓硝酸中
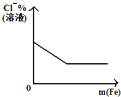
将铁粉加入到一定量氯化铁溶液中
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍,是Y原子最外层电子数的3倍。下列说法正确的是
A. X的氢化物溶于水显酸性 B. Y的氧化物是离子化合物
C. Z的氢化物比H2O稳定 D. X和Z的氧化物对应的水化物都是强酸
难度: 中等查看答案及解析
-
已知Fe3O4可表示成(FeO·Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:
3Fe2++2S2O
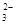 +O2+4OH-=Fe3O4+S4O62-+2H2O,下列说法正确的是( )
+O2+4OH-=Fe3O4+S4O62-+2H2O,下列说法正确的是( )A. O2和S2O
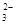 是氧化剂,Fe2+是还原剂
是氧化剂,Fe2+是还原剂B. 每生成1mol Fe3O4,则转移电子数为2mol
C. 参加反应的氧化剂与还原剂的物质的量之比为1﹕1
D. 若有2mol Fe2+被氧化,则被Fe2+还原的O2为0.5mol
难度: 困难查看答案及解析
-
将40℃的饱和石灰水冷却至10℃;或加入少量CaO,但温度仍保持40℃,在这两种情况下均未改变的是
A. Ca(OH)2的溶解度、溶剂的质量 B. 溶液中溶质的质量分数
C. 溶液的质量、水的电离平衡 D. 溶液中Ca2+的数目
难度: 中等查看答案及解析
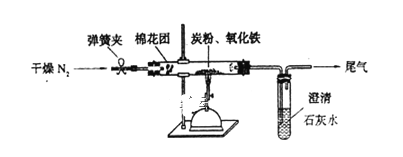
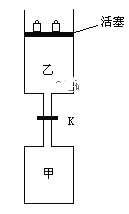
 C(g)
C(g) +2D(g);ΔH<0达到平衡(Ⅰ)时,V(乙)=0.86V L。请回答:
+2D(g);ΔH<0达到平衡(Ⅰ)时,V(乙)=0.86V L。请回答: